
【题目】(1)将下列物质进行分类:
①![]() H与
H与![]() H ②O2与O3 ③乙醇(C2H5OH) 与甲醚 (CH3—O—CH3) ④正丁烷与异丁烷 ⑤C60与金刚石;互为同分异构体的是__________________;
H ②O2与O3 ③乙醇(C2H5OH) 与甲醚 (CH3—O—CH3) ④正丁烷与异丁烷 ⑤C60与金刚石;互为同分异构体的是__________________;
(2)若将反应Fe+H2SO4===FeSO4+H2↑设计成原电池铜为原电池某一极材料,则铜为______(填“正”或“负”)极。该极上发生的电极反应为_____________________,外电路中电子由______极(填“正”或“负”,下同)向______极移动。
科目:高中化学 来源: 题型:
【题目】工业上利用氟碳铈矿(主要成分CeCO3F)提取CeCl3的一种工艺流程如下:

请回答下列问题:
(1)CeCO3F中,Ce元素的化合价为_______。
(2)酸浸过程中用稀硫酸和H2O2替换HCl不会造成环境污染。写出稀硫酸、H2O2与CeO2反应的离子方程式:____________。
(3)向Ce(BF4)3为中加入KCl溶液的目的是_________。
(4)若溶液中的Ce3+沉淀完全,此时溶液的pH为_______(己知Ksp[Ce(OH)3]=1×10-20)
(5)加热CeCl3·6H2O和NH4Cl的固体混合物可得到无水CeCl3,其中NH4Cl的作用是________。
(6)准确称取0.7500g CeCl3样品置于锥形瓶中,加入适量过硫酸铵[(NH4)2S2O8]溶液将Ce3+氧取化为Ce4+,然后用0.1000mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗25.00mL标准溶液.(己知:Fe2++Ce4+= Ce3++Fe3+)
①已知:过二硫酸的结构式为![]() ,其中S元素的化合价为:______。 过硫酸铵[(NH4)2S2O8]溶液将Ce3+氧化为Ce4+的离子方程式为:_____________。
,其中S元素的化合价为:______。 过硫酸铵[(NH4)2S2O8]溶液将Ce3+氧化为Ce4+的离子方程式为:_____________。
②该样品中CeCl3的质量分数为____________。
③若使用久置的(NH4)2Fe(SO4)2标准溶液进行滴定,测得该CeCl3样品的质童分数将______ (填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理、方法和结论都正确的是
A. 向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体
B. 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+
C. 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体,说明该钾盐是![]()
D. 向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解,部分Na2SO3被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应进行到一定程度会达到化学平衡状态,如K2Cr2O7溶液中存在平衡:Cr2![]() (橙色)+H2O
(橙色)+H2O![]() 2Cr
2Cr![]() (黄色)+2H+。平衡时各种物质含量保持不变,达到一种相对的静止(如平衡时,每消耗1molH2O同时也会生成1molH2O)。外界条件改变时,平衡状态会被破坏而发生移动(如消耗的水多于生成的水,则平衡向正向移动),平衡移动符合勒夏特列原理,即如果改变可逆反应的条件(如浓度、压强、温度等),化学平衡就被破坏,并向减弱这种改变的方向移动。现在用K2Cr2O7溶液进行下列实验:
(黄色)+2H+。平衡时各种物质含量保持不变,达到一种相对的静止(如平衡时,每消耗1molH2O同时也会生成1molH2O)。外界条件改变时,平衡状态会被破坏而发生移动(如消耗的水多于生成的水,则平衡向正向移动),平衡移动符合勒夏特列原理,即如果改变可逆反应的条件(如浓度、压强、温度等),化学平衡就被破坏,并向减弱这种改变的方向移动。现在用K2Cr2O7溶液进行下列实验:

已知:C2H5OH遇到氧化剂容易被氧化。
结合实验,下列说法不正确的是 ( )
A. ①中溶液橙色加深,③中溶液变黄 B. ②中Cr2![]() 被C2H5OH还原
被C2H5OH还原
C. 对比②和④可知K2Cr2O7酸性溶液氧化性弱 D. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲测定某NaOH溶液的物质的量浓度,可用物质的量浓度为0.1000 mol·L-1HCl 标准溶液进行中和滴定(用酚酞作指示剂)。请回答下列问题:

(1)若甲同学在实验过程中,记录滴定前滴定管内液面读数为2.10 mL,滴定后液面如图,则此时消耗HCl标准溶液的体积为________ mL。
(2)乙学生做了2组平行实验,数据记录如下:
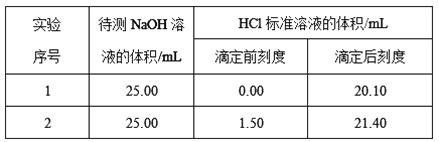
据此计算出待测NaOH溶液的物质的量浓度为____ mol·L-1(小数点后保留四位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气和二氧化氮气体在室温下可以化合生成一种新的气态化合物A,为了测定A的组成进行以下实验,取Cl2、NO2混合气总体积5L,测定反应后所得气体体积随Cl2在原混合气体中所占体积分数x的变化而变化的规律.实验测知当Cl2所占体积分数为0.2或0.6时,反应后的总体积均为4L.
(1)通过分析和计算求得化合物A的化学式为_______________________________,发生反应的化学方程式_______________________________________________________.
(2)试讨论当x的取值范围不同时,反应后总体积V随x变化的函数关系_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关工业生产的叙述中错误的是
A. 电解氯化钠溶液制金属钠
B. 石灰石是炼铁和制玻璃的原料之一
C. 氯气通入石灰乳中制漂白粉
D. 硫酸工业的主要设备有沸腾炉、接触室、吸收塔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.Cl2通入水中:Cl2+H2O=2H++Cl-+ClO-
B.双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O
C.用铜作电极电解CuSO4溶液:2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
D.Na2S2O3溶液中加入稀硫酸:2S2O32—+4H+=SO32—+3S↓+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com