
【题目】如表列出了①~⑨九种元素在周期表中的位置:
ⅠA | ⅧA | |||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑧ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
请按要求回答下列问题.
(1)元素④的名称是 ,从元素原子得失电子的角度看,元素④具有 性(填“氧化性”、“还原性”);
(2)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性: (写氢化物的化学式);
(3)元素③④⑤形成的离子半径由大到小的顺序是 (用离子符号表示)
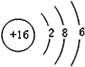
(4)元素⑦的原子结构示意图是 ;
(5)最高价氧化物对应水化物酸性最强的酸是 ,化学性质最稳定的是 金属性最强的元素是 (用化学符号表示)
【答案】(1)氧;氧化;
(2)H2O>H2S>PH3;
(3)N3﹣>O2﹣>Na+;
(4) ;
;
(5)HClO4;Ne;Na.
【解析】试题分析:由元素早周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为P、⑦为S、⑧为Ne、⑨为Cl,
(1)元素④在周期表中位置,可知其处于第二周期ⅥA族;容易获得电子;
(2)同周期从左到右非金属性增强、同主族自上而下非金属性减弱,非金属性越强,气态氢化物越稳定;
(3)离子的电子层数相同时,核电荷数越大,离子半径越小;
(4)元素⑦是S元素,硫原子核外有16个电子,有3个电子层,各层电子数为2、8、6;
(5)高氯酸的酸性最强;上述元素中Na的金属性最强,化学性质最稳定的为稀有气体.
解:由元素早周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为P、⑦为S、⑧为Ne、⑨为Cl,
(1)元素④处于第二周期ⅥA族,为氧元素;氧元素容易获得电子,表现氧化性,
故答案为:氧;氧化;
(2)同周期从左到右非金属性增强、同主族自上而下非金属性减弱,故非金属性:O>S>P,非金属性越强,气态氢化物越稳定,故氢化物稳定性:H2O>H2S>PH3,
故答案为:H2O>H2S>PH3;
(3)元素③④⑤分别为N、O、Na,形成的离子分别为N3﹣、O2﹣、Na+,离子的电子层数相同,核电荷数越大,离子半径越小,则离子半径由大到小的顺序是:N3﹣>O2﹣>Na+,
故答案为:N3﹣>O2﹣>Na+;
(4)元素⑦是S元素,硫原子核外有16个电子,有3个电子层,各层电子数为2、8、6,原子结构示意图为: ,
,
故答案为: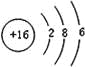 ;
;
(5)高氯酸的酸性最强,其化学式为HClO4;上述元素中化学性质最稳定的为稀有气体Ne;金属性最强的为金属Na,
故答案为:HClO4;Ne;Na.


科目:高中化学 来源: 题型:
【题目】原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:

(1)a和b用导线连接,Cu极为原电池 极(填“正”或“负”),
电极反应式为 .Zn极发生 (填“氧化”或“还原”)反应.溶液中H+移向 (填“Cu”或“Zn”)极.
(2)无论a和b是否连接,Zn片均被腐蚀.若转移了0.2mol电子,则理论上Zn片质量减轻 g.
(3)有同学想把Ba(OH)28H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行? (填“是”或“否”),理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学用语的表示正确的是( )
A.过氧化钠的电子式:![]()
B.次氯酸分子的结构式:H﹣Cl﹣O
C.C60和石墨互为同位素
D.具有10个中子的氧原子:![]() O
O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是:
A.麦芽糖及其水解产物均能发生银镜反应
B.饱和硫酸铵和醋酸铅溶液均能使鸡蛋清溶液发生变性
C.浓硫酸具有吸水性,可用于干燥CO2
D.氧化铝具有高熔点,可用作 耐火材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质按纯净物、混合物、电解质、非电解质的顺序组合的一组为( )
A.蒸馏水、氨水、氧化铝、二氧化硫
B.纯盐酸、空气、硫酸、干冰
C.胆矾、盐酸、铁、碳酸钙
D.生石灰、漂白粉、氯化铜、碳酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.碳酸氢钠溶液中加入过量的氢氧化钙溶液:2HCO![]() +Ca2++2OH-=CaCO3↓+2H2O+CO
+Ca2++2OH-=CaCO3↓+2H2O+CO![]()
B.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液恰好沉淀完全:Ba2++2OH-+2H++SO![]() =BaSO4↓+2H2O
=BaSO4↓+2H2O
C.向亚硫酸钡固体中加入稀硝酸:3BaSO3+2H++2NO![]() =3BaSO4+2NO↑+H2O
=3BaSO4+2NO↑+H2O
D.石灰乳与碳酸钠溶液混合:Ca2++CO![]() =CaCO3↓
=CaCO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 使用催化剂能够降低化学反应的反应热(△H)
B. 用向上排空气法收集铜粉与稀硝酸反应产生的NO
C. 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
D. 电镀时,待镀的金属制品表面发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容的密闭容器中进行反应A(g)═B(g)+C(g),若反应物的浓度由2molL﹣1降到0.8molL﹣1需要20s,那么反应物浓度再由0.8molL﹣1降到0.2molL﹣1所需要的时间为( )
A. 10 s B. 大于10 s C. 小于10 s D. 无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com