
【题目】下列操作或试剂的选择合理的是( )
A.焰色反应时需用稀硫酸洗净铂丝,并在火焰上灼烧至无色。
B.用湿润的pH试纸测得某碱性溶液的pH为13
C.提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法
D.用丁达尔效应可鉴别![]() 溶液和
溶液和![]() 胶体
胶体
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】根据所给信息或标志,判断下列说法错误的是()
A.在实验室和生产生活中,安全都是避免伤害和事故的保障—用肥皂液涂在天然气管道接口处检验是否漏气
B. 在运送硫酸的油罐车上贴有该标志
在运送硫酸的油罐车上贴有该标志
C. 看到有该标志的丢弃物,应远离并报警
看到有该标志的丢弃物,应远离并报警
D. 贴有该标志的物品是可回收物
贴有该标志的物品是可回收物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将24.4 g NaOH固体溶于水配成100 mL溶液,其密度为1.219 g·mL-1。
(1)该溶液中NaOH的物质的量浓度为________。
(2)该溶液中NaOH的质量分数为________。
(3)从该溶液中取出10 mL,含NaOH的质量为________,含NaOH的物质的量为________。
(4)将取出的10 mL溶液加水稀释到100 mL,稀释后溶液中NaOH的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化合物既与硫酸反应,又与氢氧化钠反应的是( )
①NaHCO3 ②NaHSO4 ③(NH4)2CO3 ④NaNO3 ⑤Al(OH)3
A.只有①B.只有③C.①②③D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】色香味俱佳、口感好的食品深受人们的喜爱。为了提高食品的质量,在生产过程中往往会加入一些能改变食品某些性质的物质。请按照题意要求填空:
(1)某课外小组学生学做比萨饼, 购买了下列食物:①西红柿、②食盐、③橄榄油④小麦粉.请回答:
其中富含淀粉的是________(填序号,下同),富含油脂的是________,富含维生素的是________,属于调味剂的是________;
(2)味精是常用的一种鲜味剂,其有效成分是谷氨酸钠,它的结构简式如下图,该物质分子中所含的官能团有________和________ (填写名称); 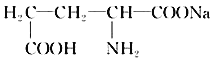
(3)碳酸氢钠是常见的疏松剂,主要是因为它在加热条件下产生了气体,使食品变得疏松。试写出碳酸氢钠受热分解的化学方程式:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1 mol时,下列说法不正确的是
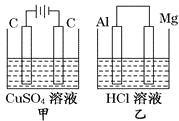
A. 溶液的质量变化:甲减小,乙增大
B. 溶液pH变化:甲减小,乙增大
C. 相同条件下产生气体的体积:V甲=V乙
D. 电极反应式:甲中阴极:Cu2++2e-==Cu,乙中负极:Mg-2e-==Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 用FeCl3溶液腐蚀铜线路板:Cu + Fe3+ = Cu2+ + Fe2+
B. 向氯化铝溶液中加入过量的氨水:Al3+ + 4NH3·H2O = AlO2- + 4NH4+ + 2H2O
C. Na2O2固体与H2O反应产生O2 :2Na2O2 + 2H2O = 4Na+ + 4OH- + O2↑
D. 向酸性KMnO4溶液中通入SO2:3SO2+2MnO+4OH-== 2MnO2↓+3SO![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2O4(g)![]() 2NO2(g) ΔH=+52.70kJ·mol-1
2NO2(g) ΔH=+52.70kJ·mol-1
(1)在恒温、恒容的密闭容器中,进行上述反应时,下列描述中,能说明该反应已达到平衡的是___。
A.v正(N2O4)=2v逆(NO2)
B.容器中气体的平均相对分子质量不随时间而变化
C.容器中气体的密度不随时间而变化
D.容器中气体的分子总数不随时间而变化
(2)t℃恒温下,在固定容积为2L的密闭容器中充入0.054molN2O4,30秒后达到平衡,测得容器中含n(NO2)=0.06mol,则t℃时反应N2O4(g)![]() 2NO2(g)的平衡常数K=___。若向容器内继续通入少量N2O4,则平衡___移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后NO2的体积分数__原平衡时NO2的体积分数(填“大于”、“小于”或“等于”)。
2NO2(g)的平衡常数K=___。若向容器内继续通入少量N2O4,则平衡___移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后NO2的体积分数__原平衡时NO2的体积分数(填“大于”、“小于”或“等于”)。
(3)取五等份NO2,分别加入到温度不同、容积相同的恒容密闭容器中,发生反应:2NO2(g)![]() N2O4(g)。反应相同时间后,分别测定体系中NO2的百分含量(NO2%),并作出其百分含量随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是___。
N2O4(g)。反应相同时间后,分别测定体系中NO2的百分含量(NO2%),并作出其百分含量随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是___。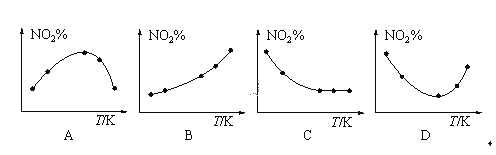
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO2(红棕色) ![]() N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
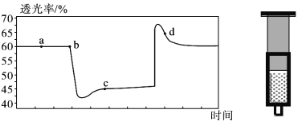
A.b点的操作是压缩注射器
B.d点:v正>v逆
C.c点与a点相比,c(NO2)增大,c(N2O4)减小
D.若不忽略体系温度变化,且没有能量损失,则Tb>Tc
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com