
【题目】下列叙述中正确的是( )
A. 聚乙烯、植物油都是混合物,都能使溴的四氯化碳溶液褪色
B. 苯、溴水、铁粉混合制成溴苯
C. 沸点:戊烷>丁烷>乙烷
D. 由丙烯加溴制1,2二溴丙烷
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是一种重要的有机化工原料。为探究草酸的制取、性质及应用,进行如下实验。
实验Ⅰ:草酸晶体的制备
实验室用硝酸氧化淀粉水解液法制备草酸,装罝如图所示:

①一定量的淀粉水解液加入三颈烧瓶中
②控制反应温度55-60℃,边搅拌边缓慢滴加一定量的混合酸
③反应3小时,冷却,抽滤后再重结晶得到草酸晶体。
(1)上图实验装置中仪器甲的名称为________。冷凝水的进口是________(填“a”或“b” )。
(2)检验淀粉是否水解完全所需要的试剂为______________。
实验Ⅱ:探究草酸与酸性高锰酸钾溶液的反应
(3)向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,可推测草酸可能具有________性。反应速率开始很慢,后来逐渐加快,可能的原因是_________。写出反应的离子方程式________________。
实验Ⅲ:草酸性质的应用
利用比H2C2O4与酸性KMnO4溶液反应探究“条件对化学反应速率的影响。”实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。设计方案如下:
编号 | H2C2O4溶液 | 酸性高锰酸钾溶液 | 温度/℃ | ||
浓度/molL-1 | 体积/mL | 浓度/molL-l | 体积/mL | ||
甲 | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
乙 | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
丙 | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(4)为了观察到紫色褪去,H2C2O4与KMnO4溶液初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4)≥________。
(5)探究温度对化学反应速率影响的实验编号是___________,探究反应物浓度对化学反应速率影响的实验编号是__________。
实验Ⅳ:草酸晶体中结晶水测定
草酸晶体的化学式可表示为H2C2O4xH2O,为测定x的值,进行下列实验:
①称取6.3g某草酸晶体配成100. 0mL的水溶液。
②取25.00mL所配溶液置于锥形瓶中,加入适量稀H2SO4,用浓度为0.5ml/L的KMnO4溶液滴定,滴定终点时消耗KMnO4的体积为10.00mL。
(6)计算x= ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示与对应叙述相符的是

A. 图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS)>Ksp(CuS)
B. 图乙表示pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
C. 图丙表示用0.1000 mol·L-lNaOH溶液滴定25.00 mL盐酸的滴定曲线,则 c(HCl)=0.0800 mol ·L-1
D. 图丁表示反应N2(g)+3H2(g) ![]() 2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.H2O的热稳定性比H2S强,是因为H2O分子间作用力比H2S强
B.离子化合物中一定含有离子键、一定不含共价键
C.NaClO是含有两种类型化学键的离子化合物
D.SiO2属于原子晶体,熔化破坏共价键和分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的要求及所给信息填空:
(1)某有机物用键线式![]() 表示的分子式__________________;
表示的分子式__________________;
系统命名法的名称是_________________________________________。
(2)烷烃A在同温、同压下蒸气的密度是H2的43倍,其分子式为___________。
(3)C4H9Cl的核磁共振氢谱表明其只有一种化学环境的氢,则A的结构简式为____________。
(4)1mol某不饱和烃可以和1molCl2发生加成反应,生成2-甲基-2,3-二氯戊烷,则该
不饱和烃结构简式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种化合物,有的是药物,有的是香料。它们的结构简式如下所示:
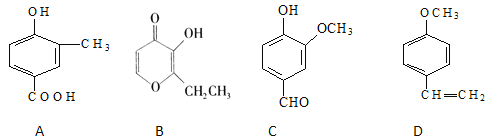
(1)化合物A的分子式是____________;C中含有的官能团的名称是_____________;
(2)A、B、C、D四种化合物中互为同分异构体的是(填序号)__________________;
(3)化合物B的核磁共振氢谱中出现_______组峰;
(4)1mol D最多能与_____________mol的氢气发生加成反应;
(5)A与乙二醇以物质的量2:1反应生成一种酯,请写出该反应的化学方程式(注明反应条件):_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.5L 1mol/L FeCl3溶液与0.2L1mol/L KCl溶液中的Cl-的数目之比
A. 5:2 B. 3:1 C. 15:2 D. 1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)甲醇是重要的化工原料,又可作为燃料。工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-58 kJ/mol
CH3OH(g)+H2O(g) ΔH=-58 kJ/mol
③CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH=+41 kJ/mol
CO(g)+H2O(g) ΔH=+41 kJ/mol
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | x |
则x=_________。
(2)若将lmol CO2和2mol H2充入容积为2L的恒容密闭容器中,在两种不同温度下发生反应②。测得CH3OH的物质的量随时间的变化如图所示。

①曲线I、Ⅱ对应的平衡常数大小关系为KI_____KⅡ(填“>”或“=”或“<”);
②一定温度下,能判断该反应达到化学平衡状态的是_____。
a.容器中压强不变 b.甲醇和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH) d.2个C=O断裂的同时有6个H—H断裂
③若5min后反应达到平衡状态,H2的转化率为90%,则用CO2表示的平均反应速率为_________,该温度下的平衡常数为_______;若容器容积不变,下列措施可增加甲醇产率的是________。
a.缩小反应容器的容积 b.使用合适的催化剂
c.充入He d.按原比例再充入CO2和H2
(3)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池。以此电池作电源,在实验室中模拟铝制品表面“钝化”处理过程(装置如图所示)。其中物质b是_____ ,阳极电极反应为____ 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com