
【题目】草酸(H2C2O4)是一种重要的有机化工原料。为探究草酸的制取、性质及应用,进行如下实验。
实验Ⅰ:草酸晶体的制备
实验室用硝酸氧化淀粉水解液法制备草酸,装罝如图所示:

①一定量的淀粉水解液加入三颈烧瓶中
②控制反应温度55-60℃,边搅拌边缓慢滴加一定量的混合酸
③反应3小时,冷却,抽滤后再重结晶得到草酸晶体。
(1)上图实验装置中仪器甲的名称为________。冷凝水的进口是________(填“a”或“b” )。
(2)检验淀粉是否水解完全所需要的试剂为______________。
实验Ⅱ:探究草酸与酸性高锰酸钾溶液的反应
(3)向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,可推测草酸可能具有________性。反应速率开始很慢,后来逐渐加快,可能的原因是_________。写出反应的离子方程式________________。
实验Ⅲ:草酸性质的应用
利用比H2C2O4与酸性KMnO4溶液反应探究“条件对化学反应速率的影响。”实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。设计方案如下:
编号 | H2C2O4溶液 | 酸性高锰酸钾溶液 | 温度/℃ | ||
浓度/molL-1 | 体积/mL | 浓度/molL-l | 体积/mL | ||
甲 | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
乙 | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
丙 | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(4)为了观察到紫色褪去,H2C2O4与KMnO4溶液初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4)≥________。
(5)探究温度对化学反应速率影响的实验编号是___________,探究反应物浓度对化学反应速率影响的实验编号是__________。
实验Ⅳ:草酸晶体中结晶水测定
草酸晶体的化学式可表示为H2C2O4xH2O,为测定x的值,进行下列实验:
①称取6.3g某草酸晶体配成100. 0mL的水溶液。
②取25.00mL所配溶液置于锥形瓶中,加入适量稀H2SO4,用浓度为0.5ml/L的KMnO4溶液滴定,滴定终点时消耗KMnO4的体积为10.00mL。
(6)计算x= ________。
【答案】 冷凝管 a 碘水或I2 还原性 反应生成的硫酸锰或锰离子对反应有催化作用,加快反应速率 5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O 2.5 乙和丙 甲和乙 2
【解析】(1)仪器甲的名称为分液漏斗,冷凝水应该遵循下进上出,应该从a进水,故答案为:分液漏斗;a;(2)淀粉遇碘变蓝色,在已经水解的淀粉溶液中滴加几滴碘液,溶液显蓝色,则证明淀粉没有完全水解,溶液若不显色,则证明淀粉完全水解,故答案为:碘水或I2;
(3)向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,可能是草酸被高锰酸钾氧化,体现了草酸的还原性。反应速率开始很慢,后来逐渐加快,可能的原因是,反应的离子方程式为5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,故答案为:还原性;反应生成的硫酸锰或锰离子对反应有催化作用,加快反应速率;5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O;
(4)高锰酸钾和草酸反应方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,为了观察到紫色褪去,草酸应该稍微过量,所以n(H2C2O4):n(KMnO4)≥2.5,故答案为:2.5;(5)探究温度对化学反应速率影响,这两组实验应该只有温度一个变量,其余条件都相同,所以应该是乙和丙;探究反应物浓度对化学反应速率影响的两组实验应该只有反应物浓度一个变量,其余条件都相同,所以应该是甲和乙;故答案为:乙和丙;甲和乙;
(6)由题给化学方程式及数据可知,5H2C2O4+2MnO4-+6H+═10CO2↑+2Mn2++8H2O,6.3g纯草酸晶体中含H2C2O4的物质的量为:0.500mol/L×10.00 mL×10-3 L/mL×![]() ×
×![]() =0.0500 mol,则6.3g H2C2O4xH2O中含H2O的物质的量为
=0.0500 mol,则6.3g H2C2O4xH2O中含H2O的物质的量为![]() =0.10 mol,0.0500mol晶体含水0.10mol,1mol晶体中含的结晶水2mol;则x=2;故答案为:2。
=0.10 mol,0.0500mol晶体含水0.10mol,1mol晶体中含的结晶水2mol;则x=2;故答案为:2。


科目:高中化学 来源: 题型:
【题目】下列保存物质方法正确的是
A. 氢氟酸保存在用塑料盖的玻璃瓶中B. 氯水应保存在棕色的细口瓶中
C. NaOH固体可长期保存在玻璃瓶中D. 金属钠应存放在四氯化碳中防止被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验,并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:
物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |

请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)____________________________________;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A中的位置,在实验开始时,为控制并测量反应溶液的温度,温度计水银球的位置应在_____________;当试管A中的主要反应完成后,为在C中收集乙酸,温度计水银球的位置应在______________,该操作名称为 _____________;烧杯B内盛装的液体可以是____________(写出一种即可,在题给物质中找);
(3)乙酸是非常重要的工业原料,其氯代物——氯乙酸可在工业上生产食品香精菠萝酯( ),实验室模拟工业简易流程如下:
),实验室模拟工业简易流程如下:

反应室I中发生反应的反应类型是___________。
分离室II的操作为:①用NaHCO3溶液洗涤后分液;②有机层用水洗涤后分液;
洗涤时不能用NaOH溶液代替NaHCO3溶液,其原因是__________________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 31g白磷(![]() )分子中含有1 NA 个P-P键
)分子中含有1 NA 个P-P键
B. 1molFeI2与1molCl2反应时转移的电子数为3NA
C. 标准状况下,4.48LCH4和乙烯(CH2=CH2)的混合气体完全燃烧,产生的水中所含O-H键数目为0.8NA
D. 常温下,将1 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属硫化物和硫酸盐在工农业生产中有广泛应用。
(1)二硫化钼(MoS2)是重要的固体润滑剂。
向体积为2L的恒容密闭容器中加入0.1molMoS2、0.2molNa2CO3,并充入0.4molH2,
发生反应:MoS2(s)+2Na2CO3(s)+4H2(g)![]() Mo(s) +2CO(g) + 4H2O(g) + 2Na2S(s) △H =akJ mol-1,测得在不同温度下达到平衡时各气体的物质的量分数如图所示。
Mo(s) +2CO(g) + 4H2O(g) + 2Na2S(s) △H =akJ mol-1,测得在不同温度下达到平衡时各气体的物质的量分数如图所示。

①a________0(填“<”“>”“=”,下同)。
②容器内的总压:P点________Q点。
③P点对应温度下,H2的平衡转化率为________,平衡常数K=________。
(2)辉铜矿(主要成分是Cu2S)在冶炼过程中会产生大量的SO2。已知冶炼过程中部分反应为:
①2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) △H=-768.2kJ/mol
②2Cu2O+Cu2S(s)=6Cu(s)+SO2(g) △H=+116kJ/mol,则Cu2S与O2反应生成Cu与SO2的热化学方程式为___________________________。
(3)回收处理SO2的方法之一是用氨水将其转化为NH4HSO3。已知常温下 Kb(NH3H2O) =1.5×l0-5 Ka1(H2SO3) =1.6×l0-2 Ka2(H2SO3)=1×10-7,若吸收过程中氨水与SO2恰好完全反应,则所得溶液在常温下的pH________7(填“>”“ <”或“=”,下同),溶液中c(SO32-)________c(H2SO3)。

(4)在500℃下硫酸铵分解会得到4种产物,其含氮物质的物质的量随时间的变化如上图所示。则该条件下硫酸铵分解的化学方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下面是石蜡油在炽热碎瓷片的作用下产生乙烯并检验其性质的实验,回答问题。

①A中碎瓷片的作用是___________。
②B中反应类型是______,C中实验现是____________________________。
(2)在一定条件下,乙烷和乙烯都能制得一氯乙烷(CH3CH2Cl),据此回答问题:
①方法一:由乙烷制备一氯乙烷的的化学方程式为:____________________。
方法二:由乙烯制备一氯乙烷的反应类型属于_______________。
比较以上两种方法,方法______较好,其原是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于盐类水解反应说法正确的是
A.任何盐都可发生水解反应
B.盐只能发生水解反应而不能发生其他反应
C.盐水解反应肯定能破坏水的电离平衡且促进水的电离
D.盐的水溶液为中性时,则盐一定不发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种物质之间有下图所示的转化关系.已知:A是空气中的主要成分,B、C、D均为化合物,且C为红棕色气体.
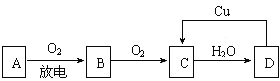
请回答下列问题:
(1)写出A和C的名称或化学式:A_________________,C________________;
(2)在上图D→C的过程中,D表现出强__________________(填“氧化性”或“还原性”);
(3)在D的稀溶液中滴入NaOH溶液,其反应的离子方程式是_________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A. 聚乙烯、植物油都是混合物,都能使溴的四氯化碳溶液褪色
B. 苯、溴水、铁粉混合制成溴苯
C. 沸点:戊烷>丁烷>乙烷
D. 由丙烯加溴制1,2二溴丙烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com