
| A、Na2CO3 |
| B、Cu2(OH)2CO3 |
| C、CH3CH2OH |
| D、Mg(OH)2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解熔融CeO2制Ce,铈在阳极获得 | ||||||||
| B、铈溶于氢碘酸的化学方程式可表示为:Ce+4HI═CeI4+2H2↑ | ||||||||
| C、用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+ | ||||||||
D、四种稳定的核素
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在H2O2+Cl2→2HCl+O2反应中,每生成32 g氧气,则转移4NA个电子 |
| B、9克甲基中含有的电子数为10NA |
| C、常温常压下,46克二氧化氮和四氧化二氮混合物中含3NA个原子 |
| D、1mol含五个碳原子的有机物,最多形成4mol碳碳单键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
16 8 |
18 8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
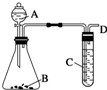 某同学用如图所示装置探究SO2的性质及其有关实验.
某同学用如图所示装置探究SO2的性质及其有关实验.查看答案和解析>>
科目:高中化学 来源: 题型:
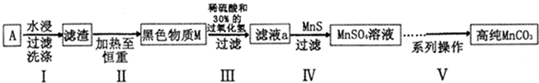
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 T/℃n/mol T/℃ | NO | CO | E | F |
| 初始 | 0.100 | 0.100 | 0 | 0 |
| T1 | 0.020 | 0.020 | 0.080 | 0.040 |
| T2 | 0.010 | 0.010 | 0.090 | 0.045 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com