
【题目】来源于电镀、冶金等行业的含六价铬(含Cr2O72-或CrO42-)废水具有很强的生物毒性,因此,含铬废水必须严格控制六价铬的质量浓度,达标后才能允许排放。一种处理含铬酸性废水的工艺如图所示:
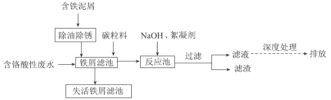
回答下列问题:
(1)去除铁屑表面油污的方法是__。
(2)酸性环境中,废水中主要存在大量Cr2O72-和少量CrO42-,原因是__(用化学用语和文字表述解释)。
(3)向“铁屑滤池"中加入碳粒料的作用是__;“铁屑滤池”中存在的Fe2+可将Cr2O72-还原,该反应的离子方程式为__。
(4)向“反应池"中加入NaOH使Cr3+沉淀,池中存在沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq)。已知:某离子浓度小于等于10-5mol·L-1时视为完全沉淀;常温下,Ksp[Cr(OH)3]=10-32。常温下,欲使废水中Cr3+完全沉淀,则溶液的pH至少应为__。
Cr3+(aq)+3OH-(aq)。已知:某离子浓度小于等于10-5mol·L-1时视为完全沉淀;常温下,Ksp[Cr(OH)3]=10-32。常温下,欲使废水中Cr3+完全沉淀,则溶液的pH至少应为__。
(5)①参照上述工艺流程知,也可采用电解原理处理含铬酸性废水,画出电解池的装置示意图并标出电极和电解质溶液的名称___(可选电极:Fe和石墨)。

②上述装置中,阳极的电极反应式为__。
【答案】将铁屑放入纯碱溶液中搅拌 2CrO42 +2 H+ ![]() H2O + Cr2O72,酸性环境,平衡正向移动,生成Cr2O72 形成原电池,加快反应速率 6Fe2+ + Cr2O72 + 14 H+ = 6Fe3+ + 2Cr3+ + 7H2O 5
H2O + Cr2O72,酸性环境,平衡正向移动,生成Cr2O72 形成原电池,加快反应速率 6Fe2+ + Cr2O72 + 14 H+ = 6Fe3+ + 2Cr3+ + 7H2O 5  Fe – 2e- = Fe2+
Fe – 2e- = Fe2+
【解析】
⑴常用纯碱除掉油污,纯碱溶液显碱性。
⑵酸性环境中,发生反应2CrO42 +2 H+ ![]() H2O + Cr2O72,利用平衡移动进行分析。
H2O + Cr2O72,利用平衡移动进行分析。
⑶向“铁屑滤池"中加入碳粒料主要分析原电池原理,“铁屑滤池”中存在的Fe2+与Cr2O72反应生成Cr3+和Fe3+。
⑷利用溶度积常数进行计算氢氧根浓度,再计算氢离子浓度,再计算pH。
⑸①参照上述工艺流程知,也可采用电解原理处理含铬酸性废水,铁变为亚铁离子,因此铁作阳极,石墨作阴极,生成的亚铁离子和重铬酸根反应,因此电解液为重铬酸钾;②阳极铁失去电子变为Fe2+。
⑴常用纯碱除掉油污,纯碱溶液显碱性,油污再碱性条件下水解而除掉,因此去除铁屑表面油污的方法是将铁屑放入纯碱溶液中搅拌、过滤;故答案为:将铁屑放入纯碱溶液中搅拌。
⑵酸性环境中,废水中主要存在大量Cr2O72和少量CrO42,原因是2CrO42 +2 H+ ![]() H2O + Cr2O72,酸性环境,平衡正向移动,生成Cr2O72;故答案为:2CrO42 +2 H+
H2O + Cr2O72,酸性环境,平衡正向移动,生成Cr2O72;故答案为:2CrO42 +2 H+ ![]() H2O + Cr2O72,酸性环境,平衡正向移动,生成Cr2O72。
H2O + Cr2O72,酸性环境,平衡正向移动,生成Cr2O72。
⑶向“铁屑滤池"中加入碳粒料的作用是形成原电池,加快反应速率;“铁屑滤池”中存在的Fe2+可将Cr2O72-还原,该反应的离子方程式为6Fe2+ + Cr2O72 + 14 H+ = 6Fe3+ + 2Cr3+ + 7H2O;故答案为:形成原电池,加快反应速率;6Fe2+ + Cr2O72 + 14 H+ = 6Fe3+ + 2Cr3+ + 7H2O。
⑷常温下,Ksp[Cr(OH)3]=1032。常温下,欲使废水中Cr3+完全沉淀,![]() ,
,![]() ,
,![]() ,则溶液的pH至少应为5;故答案为:5。
,则溶液的pH至少应为5;故答案为:5。
⑸①参照上述工艺流程知,也可采用电解原理处理含铬酸性废水,铁变为亚铁离子,因此铁作阳极,石墨作阴极,生成的亚铁离子和重铬酸根反应,因此电解液为重铬酸钾,电解池的装置示意图并标出电极和电解质溶液的名称 ;故答案为:
;故答案为: 。
。
②上述装置中,阳极的电极反应式为Fe – 2e- = Fe2+;故答案为:Fe – 2e- = Fe2+。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
【题目】下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
|
|
|
|
A.4.03米大口径碳化硅反射镜 | B.2022年冬奥会聚氨酯速滑服 | C.能屏蔽电磁波的碳包覆银纳米线 | D.“玉兔二号”钛合金筛网轮 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料是经济和生态文明建设的重要物质基础。
①生产硅酸盐水泥和普通玻璃都需用到的共同原料是___。
②橡胶是制造轮胎的重要原料,橡胶属于___(填字母)。
A.金属材料 B.无机非金属材料 C.有机高分子材料
③钢铁制品在潮湿的空气中能发生__腐蚀.发生该腐蚀时的负极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。下列说法不正确的是( )

A.水浴加热的优点为使反应物受热均匀、容易控制温度
B.浓硫酸、浓硝酸和苯混合时,应向浓硝酸中加入浓硫酸,待冷却至室温后,再将所得混合物加入苯中
C.仪器a的作用是冷凝回流,提高原料的利用率
D.反应完全后,可用仪器a、b蒸馏得到产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家获得了一种稳定性好、抗氧化能力强的活性化合物A;其结构如下:

为了研究X的结构,将化合物A在一定条件下水解只得到 和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物B能发生下列哪些类型的反应________。
A.取代反应 B.加成反应
C.缩聚反应 D.氧化反应
(2)写出化合物C所有可能的结构简式______________________________。
(3)C可通过下图所示途径合成,并制取冬青油和阿司匹林。

(ⅰ)写出有机物的结构简式:D:______________,C:________________,E:______________。
(ⅱ)写出变化过程中①、⑥的化学方程式(注明反应条件)
反应①__________________________________;反应⑥_____________________________。
(ⅲ)变化过程中的②属于____________反应,⑦属于________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中可以大量共存的是( )
A.无色透明的溶液中:Cu2+、Al3+、NO3-、SO42-
B.pH=13的溶液中:Na+、K+、SO32-、S2-
C.中性溶液中:Fe3+、Na+、Cl-、SO42-
D. =10-12的溶液中:Ca2+、NH4+、HCO3-、I-
=10-12的溶液中:Ca2+、NH4+、HCO3-、I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物N广泛应用于高分子材料、香料、医药、农药、防腐剂等行业,可通过如图转化得到(用键线式表示该转化)。下列说法错误的是( )
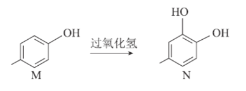
A.M→N发生氧化反应
B.M和N互为同系物
C.苯环上所连基团的种类和数目与N相同的结构还有5种(不考虑立体异构)
D.N中最多可能有15个原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸俗称草酸,为二元酸(结构简式为HOOC-COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数K1=5.0×10-2,K2=5.4×10-5;碳酸的电离平衡常数K1=4.5×10-7,K2=4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。回答下列问题:
(1)写出水溶液中草酸的电离方程式:________________________________。
(2)25℃,物质的量浓度都为0.1 mol/L的Na2C2O4溶液的pH比Na2CO3溶液pH______________________(填“大”“小”或“相等”)。
(3)常温下将0.2 mol/L的KOH溶液10 mL与0.2 mol/L的草酸溶液10 mL混合,若混合溶液显酸性,则该溶液中所有离子浓度由大到小的顺序:____________________。
(4)25℃时向20 mL碳酸钙的饱和溶液中逐滴加入1.0×10-3mol/L的草酸钾溶液20 mL,能否产生沉淀?________________(填“能”或“否”)。
(5)除去锅炉水垢中的CaSO4可先用碳酸钠溶液处理,而后用盐酸溶解,其反应的离子方程式:______________________________;________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
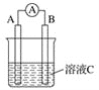
【题目】(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe ,A电极材料为Cu,则B电极的电极反应式为___________,A电极的电极反应式为_______;反应进行一段时间后溶液C的pH将___ (填“升高”“降低”或“基本不变”)。
(2)我国首创以铝空气海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是____,负极反应为___________;正极反应为_____________________________。
(3)熔盐电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。负极反应式为2CO+2CO32--4e-=4CO2,正极反应式为___________,电池总反应式为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com