
【题目】材料是经济和生态文明建设的重要物质基础。
①生产硅酸盐水泥和普通玻璃都需用到的共同原料是___。
②橡胶是制造轮胎的重要原料,橡胶属于___(填字母)。
A.金属材料 B.无机非金属材料 C.有机高分子材料
③钢铁制品在潮湿的空气中能发生__腐蚀.发生该腐蚀时的负极反应式为__。
【答案】石灰石 C 电化学 Fe﹣2e-=Fe2+
【解析】
①生产玻璃的原料是纯碱、石灰石和石英,高温下,碳酸钠、碳酸钙和二氧化硅反应分别生成硅酸钠、硅酸钙;生产水泥以黏土和石灰石为主要原料,经研磨、混合后在水泥回转窑中煅烧,再加入适量石膏,并研成细粉就得到普通水泥;所以在玻璃工业、水泥工业中都用到的原料是石灰石;故答案为:石灰石(或CaCO3);
②橡胶分为天然橡胶和合成橡胶,天然橡胶的成分是聚异戊二烯![]() 合成橡胶主要指:顺丁橡胶、氯丁橡胶、丁苯橡胶等,都为有机高分子材料,故答案为:C;
合成橡胶主要指:顺丁橡胶、氯丁橡胶、丁苯橡胶等,都为有机高分子材料,故答案为:C;
③钢铁是铁的合金在潮湿的空气中易发生电化学腐蚀;Fe失电子作负极,Fe失去电子生成二价铁离子,其电极反应为:Fe-2e-=Fe2+;故答案为:电化学;Fe-2e-=Fe2+。


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案科目:高中化学 来源: 题型:
【题目】T是一种有机药物,其合成路线如图:

已知:① ;
;
②
(1)Z中含氧官能团的名称为_______________。
(2)R的分子式为_________,R经过反应可生成S,写出S的结构简式:__________________。
(3)![]() 的反应方程式为________________、
的反应方程式为________________、![]() 的反应类型为________________。
的反应类型为________________。
(4)W是T的一种同分异构体,满足下列条件的W的结构有______________种,写出其中一种的结构简式:___________________________。
①能发生银镜反应;
②能发生水解反应,其水解产物之一能与![]() 溶液发生显色反应;
溶液发生显色反应;
③分子中只有4种不同化学环境的氢。
(5)结合本题信息,请以2-甲基-1-丙醇( )、苯为原料来合成X,写出有关的合成路线流程图(无机试剂任选)____________。合成路线流程图示例如下:
)、苯为原料来合成X,写出有关的合成路线流程图(无机试剂任选)____________。合成路线流程图示例如下:![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,用0.1mol·L-1的氨水滴定10mL0.05mol·L-1的二元酸H2X溶液,滴定过程中加入氨水的体积(V)与溶液中lg![]() 的关系如图所示。下列说法正确的是( )
的关系如图所示。下列说法正确的是( )
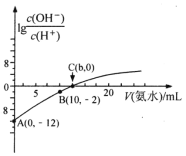
A.A点的pH等于2
B.B点溶液中离子浓度大小顺序为:c(NH4+)>c(X2-)>c(H+)>c(HX-)>c(OH-)
C.由图可知,25℃时,NH3·H2O的Kb=![]()
D.A点到C点,水的电离程度先减小后增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二醛(OHC-CHO)是一种重要的精细化工产品。长郡中学高三化学兴趣小组利用乙醛液相硝酸氧化法制备乙二醛并测定乙二醛纯度,装置如图所示。
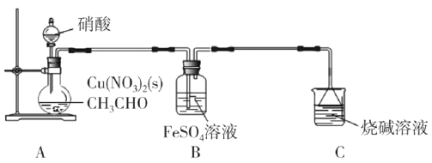
已知:①NO+FeSO4=FeSO4·NO(棕色)。
②几种有机物的部分性质如表所示:

实验步骤:
①取20mL的乙醛装于烧瓶,加入2gCu(NO3)2粉末作催化剂,向烧瓶中缓慢滴加2mol·L-1硝酸至乙醛完全反应为止;
②提纯产品,最终得到10.0mL产品。
请回答下列问题:
(1)盛装硝酸的仪器名称是__。
(2)实验中,观察到装置B中溶液变为棕色,制备乙二醛的化学方程式为__。
(3)向烧瓶中滴加硝酸要“缓慢”,其目的是__;判断烧瓶中制备乙二醛的反应已完成的标志是__。
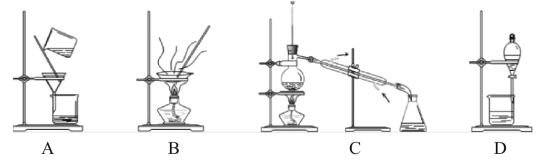
(4)分离提纯产品,宜选择下列装置__(填字母)。
(5)根据上述实验数据,该实验中乙二醛的产率约为__(填字母)。
a.56.5% b.61.8% c.67.9% d.72.6%
(6)实验室可用酸性KMnO4溶液测定乙二醛的纯度,发生反应的离子方程式为:18H++6MnO4-+5C2H2O2→10CO2↑+6Mn2++14H2O。实验步骤如下:取VmL产品,加蒸馏水稀释至250mL,量取25.00mL稀释后的溶液于锥形瓶,滴加5.00mL稀硫酸,用cmol·L-1KMnO4溶液,三次平行实验消耗KMnO4溶液体积如下:
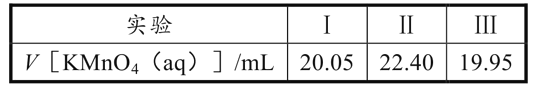
滴定终点的标志是__;该产品纯度为___g·mL-1(用含V和c的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列5种有机物:①乙炔 ②![]() ③
③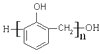 ④油脂 ⑤葡萄糖,请将相应的序号填入空格内。
④油脂 ⑤葡萄糖,请将相应的序号填入空格内。
(1)用于制造肥皂的是__。
(2)用于工业制镜的是__。
(3)用来焊接或切割金属的是__。
(4)②的单体是__(填结构简式)。
(5)③的单体是__(填结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含苯酚的工业废水的处理流程如图所示。

(1)①流程图设备Ⅰ中进行的是操作________(填写操作名称)。实验室里这一步操作可以用_______(填仪器名称)进行。
②由设备Ⅱ进入设备Ⅲ的物质A是______________(填化学式,下同)。由设备Ⅲ进入设备Ⅳ的物质B是___________。
③在设备Ⅲ中发生反应的化学方程式为_____________________。
④在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和______。通过 _________________(填操作名称)操作,可以使产物相互分离。
⑤图中,能循环使用的物质是_______、_____________C6H6和CaO。
(2)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中有无苯酚,此方法是____________。
从废水中回收苯酚的方法是①用有机溶剂萃取废液中的苯酚;②加入某种药品的水溶液使苯酚与有机溶剂脱离;③加入某物质又析出苯酚。试写出②、③两步的反应方程式:_________________________。
(3)为测定废水中苯酚的含量,取此废水100 mL,向其中加入浓溴水至不再产生沉淀为止,得到沉淀0.331 g,求此废水中苯酚的含量____________(mg·L-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二硫化钼(MoS2, 其中Mo的化合价为+4)被誉为“固体润滑剂之王”,利用低品质的辉钼矿(含MoS2、SiO2 以及CuFeS2等杂质)制备高纯二硫化钼的一种生产工艺如下:

回答下列问题:
(1)“酸浸”中加入氢氟酸是为了除去杂质SiO2,该反应的化学方程式为___________。
(2)在“氧化焙烧”过程中主要是将MoS2转化为MoO3,在该反应中氧化剂与还原剂的物质的量之比为________。
(3)若氧化焙烧产物产生烧结现象,在“氨浸”前还需进行粉碎处理,其目的是_________,“氨浸”后生成( NH4)2 MoO4反应的化学方程式为___________。
(4)向“氨浸”后的滤液中加入Na2S后,钼酸铵转化为硫代钼酸铵[(NH4)2MoS4],加入盐酸后,(NH4)2 MoS4与盐酸反应生成MoS3沉淀,沉淀反应的离子方程式为_________________。
(5)高纯MoS2中仍然会存在极微量的非整比晶体MoS2.8等杂质,在该杂质中为保持电中性,Mo元素有+4、+6两种价态,则MoS2中Mo4+所占Mo元素的物质的量分数 为__________。
为__________。
(6)钼酸钠晶体( Na2 MoO4 2H2O)是一种无公害型冷却水系统金属缓蚀剂,可以由MoS2制备。在制备过程中需加入Ba(OH)2固体除去SO42-,若溶液中c(MoO42-)=0.4 mol/L,c(SO42-)=0. 05 mol/L,常温下,当BaMoO4即将开始沉淀时,SO42-的去除率为____________ [忽略溶液体积变化。已知:259℃,Ksp( BaMoO4)=4.0×10-8 , Ksp(BaSO4)=1.1×10-10]。
查看答案和解析>>
科目:高中化学 来源: 题型:
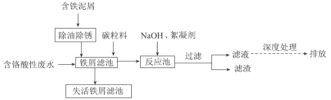
【题目】来源于电镀、冶金等行业的含六价铬(含Cr2O72-或CrO42-)废水具有很强的生物毒性,因此,含铬废水必须严格控制六价铬的质量浓度,达标后才能允许排放。一种处理含铬酸性废水的工艺如图所示:
回答下列问题:
(1)去除铁屑表面油污的方法是__。
(2)酸性环境中,废水中主要存在大量Cr2O72-和少量CrO42-,原因是__(用化学用语和文字表述解释)。
(3)向“铁屑滤池"中加入碳粒料的作用是__;“铁屑滤池”中存在的Fe2+可将Cr2O72-还原,该反应的离子方程式为__。
(4)向“反应池"中加入NaOH使Cr3+沉淀,池中存在沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq)。已知:某离子浓度小于等于10-5mol·L-1时视为完全沉淀;常温下,Ksp[Cr(OH)3]=10-32。常温下,欲使废水中Cr3+完全沉淀,则溶液的pH至少应为__。
Cr3+(aq)+3OH-(aq)。已知:某离子浓度小于等于10-5mol·L-1时视为完全沉淀;常温下,Ksp[Cr(OH)3]=10-32。常温下,欲使废水中Cr3+完全沉淀,则溶液的pH至少应为__。
(5)①参照上述工艺流程知,也可采用电解原理处理含铬酸性废水,画出电解池的装置示意图并标出电极和电解质溶液的名称___(可选电极:Fe和石墨)。

②上述装置中,阳极的电极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4—CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4—CO2催化重整反应为CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g)ΔH=-75kJ·mol-1
C(s)+O2(g)=CO2(g)ΔH=-394kJ·mol-1
C(s)+![]() O2(g)=CO(g)ΔH=-111kJ·mol-1
O2(g)=CO(g)ΔH=-111kJ·mol-1
该催化重整反应的ΔH=__kJ·mol-1。有利于提高CH4平衡转化率的条件是___(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2L的容器中加入2molCH4、1molCO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为___mol2·L-2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
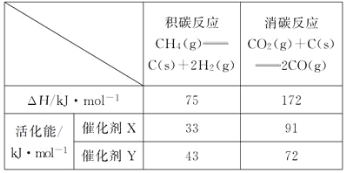
①由上表判断,催化剂X__Y(填“优于”或“劣于”),理由是___。
在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是__(填标号)。
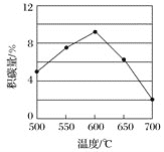
A.K积、K消均增加
B.v积减小、v消增加
C.K积减小、K消增加
D.v消增加的倍数比v积增加的倍数大
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为___。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com