
ЁОЬтФПЁПXЁЂYЁЂZЁЂWЮЊЖЬжмЦкжїзхдЊЫиЃЌЫќУЧЕФзюИпе§ЛЏКЯМлКЭдзгАыОЖШчЯТБэЫљЪОЃК
дЊЫи | X | Y | Z | W |
зюИпе§ЛЏКЯМл | +3 | +1 | +5 | +7 |
дзгАыОЖ | 0.082 | 0.186 | 0.110 | 0.099 |
дђЯТСаЫЕЗЈДэЮѓЕФЪЧ
A.XЕФзюИпМлбѕЛЏЮяЖдгІЕФЫЎЛЏЮяОпгаСНад
B.ZW3ЗжзгжаЫљгадзгзюЭтВуОљТњзу8eЃНсЙЙ
C.YЕФвЛжжбѕЛЏЮяПЩгУзїЙЉбѕМСЃЌZЕФвЛжжбѕЛЏЮяПЩгУзїИЩдяМС
D.МђЕЅЦјЬЌЧтЛЏЮяЕФШШЮШЖЈадЃКW>Z>X
ЁОД№АИЁПA
ЁОНтЮіЁП
ИљОнXЁЂYЁЂZЁЂWЮЊЖЬжмЦкжїзхдЊЫиЃЌСЊЯЕзюИпе§ЛЏКЯМлЃЌXПЩгыЮЊBдЊЫиЛђепAlдЊЫиЃЌYЮЊLiдЊЫиЛђNaдЊЫиЃЌZЮЊNдЊЫиЛђPдЊЫиЃЌWЮЊClдЊЫиЃЌгждзгАыОЖЃКY>Z>Cl>XЃЌдђXЮЊBдЊЫиЃЌYЮЊNaдЊЫиЃЌZЮЊPдЊЫиЃЌОнДЫЗжЮіЛиД№ЮЪЬтЁЃ
AЃЎBЕФзюИпМлбѕЛЏЮяЖдгІЕФЫЎЛЏЮяH2BO3ЪЧШѕЫсЃЌВЛОпгаСНадЃЌAбЁЯюДэЮѓЃЛ
BЃЎPCl3ЕФЕчзгЪНЮЊ![]() ЃЌЫљгадзгзюЭтВуОљТњзу8eЃНсЙЙЃЌBбЁЯюе§ШЗЃЛ
ЃЌЫљгадзгзюЭтВуОљТњзу8eЃНсЙЙЃЌBбЁЯюе§ШЗЃЛ
CЃЎNaЕФбѕЛЏЮяNa2O2ПЩзїЙЉбѕМСЃЌPЕФбѕЛЏЮяP2O5ЪЧЫсадИЩдяМСЃЌCбЁЯюе§ШЗЃЛ
DЃЎЗЧН№ЪєаддНЧПЃЌМђЕЅЦјЬЌЧтЛЏЮяЕФШШЮШЖЈаддНЧПЃЌЗЧН№ЪєадCl>P>BЃЌдђШШЮШЖЈадЃКHCl>PH3>BH3ЃЌDбЁЯюе§ШЗЃЛ
Д№АИбЁAЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯжгавдЯТгаЛњЮяЃКЂй ![]() Ђк
Ђк ![]() Ђл
Ђл ![]() Ђм
Ђм ![]() ЂнБНЗг(ЬюађКХ)
ЂнБНЗг(ЬюађКХ)
ЃЈ1ЃЉФмгыNaЗДгІЕФЪЧ ________ ЃЛ
ЃЈ2ЃЉФмгы![]() ШмвКЗДгІЕФга_________ЃЛ
ШмвКЗДгІЕФга_________ЃЛ
ЃЈ3ЃЉФмгыNaHCO3ШмвКЗДгІгаЦјХнВњЩњЕФЪЧ_______________ЃЛ
ЃЈ4ЃЉФмгывјАБШмвКЗЂЩњвјОЕЗДгІЕФга____________________ЃЛ
ЃЈ5ЃЉМШФмЗЂЩњЯћШЅЗДгІЃЌгжФмЗЂЩњѕЅЛЏЗДгІЕФга___________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПбЧЩщЫс(H3AsO3)ПЩвдгУгкжЮСЦАзбЊВЁЃЌЦфдкШмвКжаДцдкЖржжЮЂСЃаЮЬЌЃЌНЋKOHШмвКЕЮШыбЧЩщЫсШмвКЃЌИїжжЮЂСЃЮяжЪЕФСПЗжЪ§гыШмвКЕФpHЙиЯЕШчЭМЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЃЈ ЃЉ

A.ШЫЬхбЊвКЕФpHдк7.35ЁЋ7.45жЎМфЃЌгУвЉКѓШЫЬхжаКЌAsдЊЫиЕФжївЊЮЂСЃЪЧAsO33-
B.n(H3AsO3)ЁУn(H2AsO3-)=1ЁУ1ЪБЃЌШмвКЯдЫсад
C.ЕБpHЕїжС11ЪБЗЂЩњЗДгІЕФРызгЗНГЬЪНЪЧH3AsO3+OH-=H2AsO3-+H2O
D.pH=12ЪБЃЌШмвКжаc(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(OH-)=c(H+)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЬьУХЖЌАБЫсаПЪЧвЛжжВЙаПМСЃЌПЩвд![]() ЁЂЬьУХЖЌАБЫс(
ЁЂЬьУХЖЌАБЫс(![]() )ЮЊдСЯжЦБИЁЃЛиД№ЯТСаЮЪЬтЃК
)ЮЊдСЯжЦБИЁЃЛиД№ЯТСаЮЪЬтЃК
(1)ZnГЩЮЊбєРызгЪБЪзЯШЪЇШЅ______ЙьЕРЕчзгЁЃэк(Te)гыOЭЌжїзхЃЌдђTeдЊЫижаЕчзгеМОнЕФФмСПзюИпЕФФмМЖЪЧ______ЁЃ
(2)PЪЧNЕФЭЌзхдЊЫиЃЌPH3гыNH3жаЮШЖЈадИќИпЕФЪЧ______(ЬюЛЏбЇЪН)ЃЌЦфХаЖЯРэгЩЪЧ______ЃЛЬЊнМЭПЩгУгкЩњВњРЖЩЋбеСЯ(НсЙЙШчЭМ)ЃЌЦфжаCдзгЕФЙьЕРдгЛЏРраЭЮЊ______ЁЃ
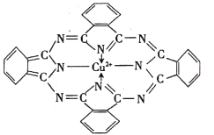
(3)COЮЊ______(ЬюЁАМЋадЁБЛђЁАЗЧМЋадЁБ)ЗжзгЁЃ
(4)ZnOОЇЬхЕФвЛжжОЇАћНсЙЙШчЭМЃК
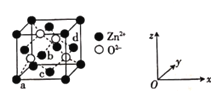
Ђй![]() ЕФХфЮЛЪ§ЮЊ____________ЁЃ
ЕФХфЮЛЪ§ЮЊ____________ЁЃ
ЂквдОЇАћБпГЄЮЊЕЅЮЛГЄЖШНЈСЂЕФзјБъЯЕПЩБэЪООЇАћжааПдзгЕФЮЛжУЃЌГЦзїдзгЗжЪ§зјБъЁЃЭМжадзгaЕФЗжЪ§зјБъЮЊ![]() ЃЌдзгdЕФЗжЪ§зјБъЮЊ
ЃЌдзгdЕФЗжЪ§зјБъЮЊ![]() ЃЌдђдзгbКЭcЕФЗжЪ§зјБъЗжБ№ЮЊ______ЁЂ______ЁЃ
ЃЌдђдзгbКЭcЕФЗжЪ§зјБъЗжБ№ЮЊ______ЁЂ______ЁЃ
ЂлЩш![]() ЮЊАЂЗќМгЕТТоГЃЪ§ЕФжЕЁЃвбжЊОЇАћБпГЄЮЊ
ЮЊАЂЗќМгЕТТоГЃЪ§ЕФжЕЁЃвбжЊОЇАћБпГЄЮЊ![]() nmЃЌдђZnOОЇЬхЕФУмЖШЮЊ______(СаГіМЦЫуЪН)
nmЃЌдђZnOОЇЬхЕФУмЖШЮЊ______(СаГіМЦЫуЪН)![]() ЁЃ
ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЛЏКЯЮяHЪЧживЊЕФгаЛњЮяЃЌПЩгЩEКЭFдквЛЖЈЬѕМўЯТКЯГЩ(ВПЗжЗДгІЮяЛђВњЮяЪЁТдЃЌСэЧызЂвтМ§ЭЗЕФжИЯђ)ЃК
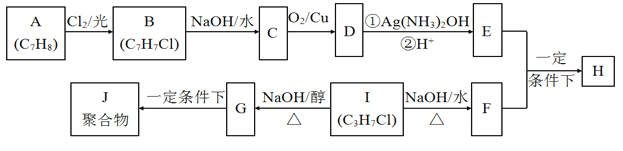
вбжЊвдЯТаХЯЂЃК
i.AЪєгкЗМЯуЬўЃЌHЪєгкѕЅРрЛЏКЯЮяЃЛ
ii.IЕФКЫДХЙВеёЧтЦзгаСНзщЗхЃЌЧвЗхЕФУцЛ§БШЮЊ6:1ЁЃ
ЛиД№ЯТСаЮЪЬтЃК
(1)EЕФКЌбѕЙйФмЭХУћГЦЮЊ____________________ЃЌBЕФНсЙЙМђЪНЮЊ___________________ЁЃ
(2)BЁњCКЭGЁњJСНВНЕФЗДгІРраЭ____________________ЃЛ_______________________ЁЃ
(3)ЂйE+FЁњHЕФЛЏбЇЗНГЬЪНЃК_________________________________ЁЃ
ЂкDгывјАБШмвКЗДгІЕФЛЏбЇЗНГЬЪНЃК___________________________ЁЃ
(4)IЕФЭЌЯЕЮяKБШIЯрЖдЗжзгжЪСПДѓ28ЃЌKгаЖржжЭЌЗжвьЙЙЬхЁЃ
ЂйKЕФЭЌЗжвьЙЙЬхЙВ_______________жжЁЃ
ЂкШєKВЛФмЗЂЩњЯћШЅЗДгІЃЌдђKЕФНсЙЙМђЪНЮЊ_____________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЃЈ1ЃЉЬМЫсЃКH2CO3ЃЌK1ЃН4.3ЁС10Љ7ЃЌK2ЃН5.6ЁС10Љ11
ВнЫсЃКH2C2O4ЃЌK1ЃН5.9ЁС10Љ2ЃЌK2ЃН6.4ЁС10Љ5
0.1mol/L Na2CO3ШмвКЕФpH_____0.1mol/L Na2C2O4ШмвКЕФpHЃЛЃЈбЁЬюЁАДѓгкЁБЁАаЁгкЁБЛђЁАЕШгкЁБЃЉ
ЃЈ2ЃЉЕШХЈЖШЕФВнЫсШмвККЭЬМЫсШмвКжаЃЌЧтРызгХЈЖШНЯДѓЕФЪЧ_____ЃЛШєНЋЕШХЈЖШЕФВнЫсШмвККЭЬМЫсШмвКЕШЬхЛ§ЛьКЯЃЌШмвКжаИїжжРызгХЈЖШДѓаЁЕФЫГађе§ШЗЕФЪЧ_____ЃЈбЁЬюБрКХЃЉЃЛ
aЃЎc(H+)ЃОc(HC2O![]() )ЃОc(HCO
)ЃОc(HCO![]() )ЃОc(CO
)ЃОc(CO![]() )
)
bЃЎc(HCO![]() )ЃОc(HC2O
)ЃОc(HC2O![]() )ЃОc(C2O
)ЃОc(C2O![]() )ЃОc(CO
)ЃОc(CO![]() )
)
cЃЎc(H+)ЃОc(HC2O![]() )ЃОc(C2O
)ЃОc(C2O![]() )ЃОc(CO
)ЃОc(CO![]() )
)
dЃЎc(H2CO3)ЃОc(HCO![]() )ЃОc(HC2O
)ЃОc(HC2O![]() )ЃОc(CO
)ЃОc(CO![]() )
)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТЃЌЯђ20 mL 0.1molЁЄLЃ1вЛдЊЫсHAжаЕЮМгЯрЭЌХЈЖШЕФKOHШмвКЃЌШмвКжагЩЫЎЕчРыЕФЧтРызгХЈЖШЫцМгШыKOHШмвКЬхЛ§ЕФБфЛЏШчЭМЫљЪОЁЃдђЯТСаЫЕЗЈДэЮѓЕФЪЧ
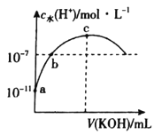
A.HAЕФЕчРыГЃЪ§дМЮЊ10Ѓ5
B.bЕуШмвКжаДцдкЃКc(AЃ)ЃНc(KЃЋ)
C.cЕуЖдгІЕФKOHШмвКЕФЬхЛ§VЃН20 mLЃЌcЫЎ(HЃЋ)дМЮЊ7ЁС10Ѓ6 molЁЄLЃ1
D.ЕМЕчФмСІЃКc>a>b
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиЮяжЪНсЙЙКЭаджЪЕФа№ЪіВЛе§ШЗЕФЪЧЃЈ ЃЉ
A.МзБНПЩвдБЛЫсад![]() ШмвКбѕЛЏГЩБНМзЫсЃЌЖјввЭщВЛФмБЛЦфбѕЛЏЃЌЫЕУїБНЛЗЖдВрСДВњЩњСЫгАЯь
ШмвКбѕЛЏГЩБНМзЫсЃЌЖјввЭщВЛФмБЛЦфбѕЛЏЃЌЫЕУїБНЛЗЖдВрСДВњЩњСЫгАЯь
B.БНЗгФмгыЧтбѕЛЏФЦШмвКЗДгІЖјввДМВЛФмЃЌЫЕУїБНЛЗЖдєЧЛљВњЩњСЫгАЯь
C.ЖўТШМзЭщжЛгавЛжжНсЙЙЃЌЫЕУїМзЭщЕФЗжзгЙЙаЭВЛЪЧЦНУцаЭ
D.МфЖўМзБНжЛгавЛжжНсЙЙЃЌЫЕУїБНЛЗжаВЛДцдкЕЅЫЋМќНЛЬцГіЯжЕФНсЙЙ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТЃЌЯђ20 mL 0.1molЁЄL-1ЕФбЮЫсжаж№ЕЮМгШы0.1 molЁЄL-1ЕФАБЫЎЃЌШмвКpHЕФБфЛЏгыМгШыАБЫЎЕФЬхЛ§ЙиЯЕШчЭМЫљЪОЁЃЯТСаа№ЪіВЛе§ШЗЕФЪЧ
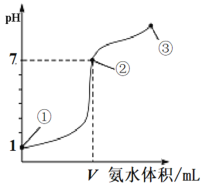
A.VЃО20 mL
B.ЂйЁЂЂкЁЂЂлЕуЫЎЕФЕчРыГЬЖШДѓаЁЮЊЃКЂкЃОЂлЃОЂй
C.дкЕуЂкЫљЪОШмвКжаЃКc(ClЃ)ЃНc(NH3ЁЄH2O)ЃЋc(NH![]() )
)
D.дкЕуЂкЁЂЂлжЎМфПЩФмДцдкЃКc(NH![]() )ЃОc(ClЃ)ЃНc(OHЃ)ЃОc(H+)
)ЃОc(ClЃ)ЃНc(OHЃ)ЃОc(H+)
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com