
【题目】下列离子方程式能正确描述实验事实的是
A.向NH4HSO4溶液中滴加NaOH溶液至中性:H++OH-=H2O
B.用KIO3氧化酸性溶液中的KI:5I-+![]() +6H+=3I2+3H2O
+6H+=3I2+3H2O
C.用醋酸中和碳酸氢钠:![]() +H+=H2O+CO2↑
+H+=H2O+CO2↑
D.向酸性KMnO4溶液中滴加少量H2O2,紫色褪去:![]() +H2O2+6H+=2Mn2++3O2↑+4H2O
+H2O2+6H+=2Mn2++3O2↑+4H2O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】柔红酮是一种医药中间体,其结构简式如图所示。下列说法正确的是( )
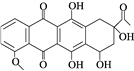
A. 每个柔红酮分子中含有2个手性碳原子
B. 柔红酮分子中所有的碳原子都在同一个平面上
C. 1 mol柔红酮最多可与2 mol Br2发生取代反应
D. 一定条件下柔红酮可发生氧化、加成、消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学做如下实验: 上面对照实验不能完成实验目的的是

A.![]() 、
、![]() 对照,比较
对照,比较![]() 、
、![]() 中羟基氢原子的活泼性
中羟基氢原子的活泼性
B.![]() 、
、![]() 对照,说明
对照,说明![]() 中存在不同于烃分子中的氢原子
中存在不同于烃分子中的氢原子
C.![]() 、
、![]() 对照,能说明苯环对羟基的化学性质产生影响
对照,能说明苯环对羟基的化学性质产生影响
D.![]() 和
和![]() 、
、![]() 和
和![]() 对照,说明官能团对有机物的化学性质起决定作用
对照,说明官能团对有机物的化学性质起决定作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以苯甲醛为原料制备间溴苯甲醛的反应如下:
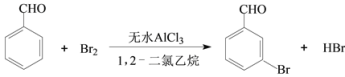
已知:(1)间溴苯甲醛温度过高时易被氧化。
(2)溴、苯甲醛、1,2-二氯乙烷、间溴苯甲醛的沸点见下表:
物质 | 溴 | 苯甲醛 | 1,2-二氯乙烷 | 间溴苯甲醛 |
沸点/℃ | 58.8 | 179 | 83.5 | 229 |
步骤1:将一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后装入三颈烧瓶(如右图所示),缓慢滴加经浓硫酸干燥过的足量液溴,控温反应一段时间,冷却。

步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机层用10% NaHCO3溶液洗涤。
步骤3:经洗涤的有机层加入适量无水MgSO4固体,放置一段时间后过滤出
MgSO4nH2O晶体。
步骤4:减压蒸馏有机层,收集相应馏分。
(1)实验装置中冷凝管的主要作用是_____,锥形瓶中应为_____(填化学式)溶液。
(2)步骤1反应过程中,为提高原料利用率,适宜的温度范围为(填序号)_______。
A.>229℃ B.58.8℃~179℃ C.<58.8℃
(3)步骤2中用10% NaHCO3溶液洗涤,是为了除去溶于有机层的___(填化学式)。
(4)步骤3中加入无水MgSO4固体的作用是_____。
(5)步骤4中采用减压蒸馏,是为了防止______。
(6)若实验中加入了5.3 g苯甲醛,得到3.7 g间溴苯甲醛。则间溴苯甲醛产率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为了解有机物A的性质,对A的结构进行了如下实验。
实验一:通过质谱分析仪分析得知有机物A的相对分子质量为90。
实验二:用红外光谱分析发现有机物A中含有—COOH和 —OH。
实验三:取1.8g有机物A完全燃烧后,测得生成物为2.64gCO2和1.08gH2O。
实验四:经核磁共振检测发现有机物A的谱图中H原子峰值比为3:1:1:1。
(1)有机物A的结构简式为_______。
(2)有机物A在一定条件下可以发生的反应有_______。
a.消去反应 b.取代反应 c.聚合反应 d.加成反应 e.氧化反应
(3)有机物A在浓硫酸作用下可生成多种产物。其中一种产物B的分子式为C3H4O2,B能和溴发生加成反应,则B的结构简式为_______。另一种产物C是一种六元环状酯,写出生成C的化学方程式:_______。
(4)写出A与足量的金属钠反应的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法正确的是
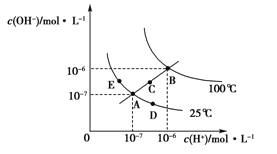
A. 图中五点KW间的关系:B>C>A=D=E
B. 若从A点到D点,可采用在水中加入少量NaOH的方法
C. 若从A点到C点,可采用温度不变时在水中加入适量H2SO4 的方法
D. 若处在B点时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用具有重要的社会意义。回答下列问题:
(1)CO可用于高炉炼铁,已知:
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2 (g) △H1= a kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2 (g) △ H2= b kJ/mol
则反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 (g)的△H=________kJ/mol
(2)某温度下,在容积为2 L的密闭容器甲中投入8molCO2(g)、16molH2(g)发生反应:
CO2 (g)+H2(g) ![]() CO(g)+H2O(g)
CO(g)+H2O(g)
甲容器15 min后达到平衡,此时CO2的转化率为75%。则015 min内用二氧化碳表示平均反应速率v(CO2)=_______,计算此条件下该反应的平衡常数K= __________。
(3)捕碳技术是指从空气中捕获二氧化碳的各种科学技术的统称。目前NH3和(NH4)2CO3等物质已经被用作工业捕碳剂。
①下列物质中不可能作为CO2捕获剂的是___________。
A.Na2CO3 B.NaOH C.CH3CH2OH D.NH4Cl
②用(NH4)2CO3捕碳的反应:(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
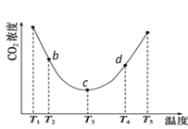
I. c点的逆反应速率和d点的正反应速率的大小关系为
V逆c _____V正d (填“>”、“=”或“<”)
II. b、c、d三点的平衡常数K b 、K c、 Kd 从大到小的顺序为_______。(填“>”、“=”或“<”)
III.T3~T4温度区间,容器内CO2气体浓度呈现增大的变化趋势,其原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组欲根据侯德榜制碱的原理制备少量纯碱。下列实验步骤对应的实验装置(夹持装置已略去)和相关解释或说明均正确的是( )
选项 | A | B | C | D |
实验步骤 | 制备NH3 | 制备NaHCO3 | 分离NaHCO3 | 煅烧NaHCO3 |
实验装置 |
|
|
|
|
解释或说明 | 试剂X可选择NH4Cl | 从a口通入足量NH3,再从b口通入足量CO2,可增大产品的产率 | 该装置可用于分 离NaHCO3 | 无水CuSO4的作用是检验NaHCO3是否完全分解 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在氨水中存在下列平衡:NH3+H2O![]() NH3H2O
NH3H2O![]() NH
NH![]() +OH-。
+OH-。
(1)向氨水中加入MgCl2固体时,平衡向__移动,OH-离子的浓度__,NH![]() 离子的浓度__;
离子的浓度__;
(2)向氨水中加入浓盐酸,平衡向__移动,此时溶液中浓度减小的微粒有__、__、__;
(3)向浓氨水中加入少量的NaOH固体,平衡向__移动,此时发生的现象是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com