
【题目】(1)CO2经过催化氢化合成低碳烯烃.其合成乙烯的反应为2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
物质 | H-H | C=O | C=C | C-H | H-O |
能量/kJmol-1 | 436 | 745 | 615 | 413 | 463 |
则△H=_____________________。
(2)工业上常用电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为2:1。

①气体甲的化学式____________ 。
②a极与电源的____________ (填“正极”或“负极”)相连,该电极反应式为_______________。
③离子交换膜d为________(填“阴离子”或“阳离子”)交换膜。
④产物丙为_________ 溶液。
【答案】-375kJ·mol-1 H2 负极 2H2O +2e- = H2↑ + 2OH- 阴离子 NaOH
【解析】
(1)△H=断键吸收的能量-成键释放的能量
(2)电解硫酸钠溶液的实质为电解水,在阴阳两极分别产生H2和O2,其体积比为2:1,电解过程中,气体甲与气体乙的体积比约为2:1,故甲气体为氢气,乙气体为氧气,a为阴极,b为阳极,即可判断出相应答案。
(1)2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g)△H=745kJ/mol×4+436kJ/mol×6-615kJ/mol-413kJ/mol×4-463kJ/mol×8=-375kJ·mol-1
CH2=CH2(g)+4H2O(g)△H=745kJ/mol×4+436kJ/mol×6-615kJ/mol-413kJ/mol×4-463kJ/mol×8=-375kJ·mol-1
(2)①该电解实质为电解水,阳极为2H2O-4e-=4H++O2↑,阴极为4H2O+4e-=2H2↑+4OH-,因为气体甲与气体乙的体积比约为2:1,所以甲气体为氢气,a为阴极,乙气体为氧气,b为阳极;
②a为阴极,与电源的负极相连;该电极反应式为2H2O +2e- = H2↑+ 2OH- ;
③b为阳极,OH-放电,产生硫酸溶液,所以SO42-向b极移动,离子交换膜d为阴离子交换膜;
④a为阴极,4H2O+4e-=2H2↑+4OH-,故丙为烧碱溶液;


科目:高中化学 来源: 题型:
【题目】煤燃烧过程中加入石灰石可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是燃烧过程中产生的CO又会与CaSO4发生化学反应,降低了脱硫效率。发生的两个相关反应的热化学方程式如下:
反应Ⅰ:CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) ΔH1=+218.4 kJ·mol-1
CaO(s)+SO2(g)+CO2(g) ΔH1=+218.4 kJ·mol-1
反应Ⅱ:CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g) ΔH2=-175.6 kJ·mol-1
CaS(s)+4CO2(g) ΔH2=-175.6 kJ·mol-1
已知:①反应Ⅰ和反应Ⅱ同时发生 ②反应Ⅰ的速率大于反应Ⅱ的速率
下列反应过程能量变化示意图正确的是
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题。
(1)现有下列10种物质:
①纯碱 ②Mn2O7 ③硫酸 ④CaO ⑤CO2 ⑥小苏打 ⑦K2SO3 ⑧SO2 ⑨Na2O2 ⑩CO。
其中属于正盐的是__________;属于酸性氧化物的是_________。
(2)实验室制备Fe(OH)3胶体的化学方程式为___________________,取少量Fe(OH)3胶体于试管中,逐滴加入硫酸至过量,可看到的现象是___________________。将橘红色的硫化锑(Sb2S3)胶体,装入U形管,插入电极后通直流电,发现阳极附近橘红色加深,证明Sb2S3胶粒带____(填“正”或“负”)电荷。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运载火箭以液氢为燃烧剂,液氧为氧化剂。已知:
①H2(g)=H2(l) ΔH=-0. 92 kJ·mol-1 ②O2(g)=O2(l) ΔH=-6. 84 kJ·mol-1
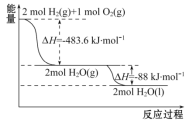
下列说法正确的是
A. 2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g)所具有的总能量低
B. 氢气的燃烧热为ΔH=-241. 8 kJ·mol-1
C. 火箭中液氢燃烧的热化学方程式为2H2(l)+O2(l)![]() 2H2O(g) ΔH=-474. 92 kJ·mol-1
2H2O(g) ΔH=-474. 92 kJ·mol-1
D. H2O(g)变成H2O(l)的过程中,断键吸收的能量小于成键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各式中,能正确表示其对应化学意义的是
A. CO32-+2H2O ![]() H2CO3+2OH- B. NaHSO4= Na+ + HSO4-
H2CO3+2OH- B. NaHSO4= Na+ + HSO4-
C. NaHCO3 = Na+ + HCO3- D. OH-+ HCO3-= CO2 ↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaAlH4(四氢铝钠)是有机合成的重要还原剂。某小组以铝合金厂的废边脚料为原料(主要成分为Al,含有少量Al2O3、Fe2O3,MgO和SiO2、等杂质制备四氢铝钠的工艺流程如下:

资料显示:NaH、NaAlH4遇水蒸气发生剧烈反应。
请回答下列问题:
(1) NaAlH4中氢元素的化合价为___________。
(2)试剂A中溶质的阴、阳离子所含电子数相等,其电子式为___________。在空气中灼烧滤渣2,得到的固体的主要成分为___________(填化学式)。
(3)滤液3可以循环利用,写出滤液2与滤液3反应的离子方程式:___________。
(4)实验前要保证NaH与AlC13反应的装置干燥,其目的是___________________。
(5)已知废料接触面积、接触时间均相同,“酸浸”中铝元素浸出率与硫酸浓度的关系如图所示。当硫酸浓度大于 C0 mol·L-1时,浸出率降低的原因可能是___________。

(6)测定NaAlH4粗产品的纯度。
称取 m g NaAlH4粗产品按如图所示装置进行实验,测定产品的纯度。
①“安全漏斗”中“安全”的含义是____________________________________________。
②已知实验前B管读数为xmL,向A中加入足量蒸馏水,当A中反应完全后,冷却至室温B管读数为ymL(均折合成标准状况)。则该产品的纯度为___________(用含m、x和y的代数式表示)。
③若实验前读数时B管和C管液面相平,实验后读数时B管液面低于C管,则测得的结果___________(填“偏高”“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又是吸热反应的是
A. 灼热的炭与CO2的反应
B. Na2O2与H2O的反应
C. 镁条与稀盐酸的反应
D. 碳酸钙高温分解的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验中不能直接测出石墨和氢气生成甲烷反应的反应热,但可测出甲烷、石墨、氢气燃烧的反应热:CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1=-890.3kJ/mol
C(石墨)+O2(g)=CO2(g) ΔH2=―393.5kJ/mol
H2(g)+1/2O2(g)=H2O(l) ΔH3=―285.8kJ/mol,
则由石墨生成甲烷的反应热:C(石墨)+2H2(g)=CH4(g) ΔH 4= _________________。
(2)体积相同,pH均等于1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m________n(填>、<、= )
(3)常温下,某一元酸HA的Ka=2×10-6,则0.5 mol/L该酸溶液的PH =______。
(4)取浓度相等的NaOH和HCl溶液,以3∶2体积比相混和,所得溶液的pH等于12,则原溶液的浓度为_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com