
【题目】回答下列问题。
(1)现有下列10种物质:
①纯碱 ②Mn2O7 ③硫酸 ④CaO ⑤CO2 ⑥小苏打 ⑦K2SO3 ⑧SO2 ⑨Na2O2 ⑩CO。
其中属于正盐的是__________;属于酸性氧化物的是_________。
(2)实验室制备Fe(OH)3胶体的化学方程式为___________________,取少量Fe(OH)3胶体于试管中,逐滴加入硫酸至过量,可看到的现象是___________________。将橘红色的硫化锑(Sb2S3)胶体,装入U形管,插入电极后通直流电,发现阳极附近橘红色加深,证明Sb2S3胶粒带____(填“正”或“负”)电荷。
【答案】①⑦ ②⑤⑧ FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl 先有沉淀生成后沉淀消失 负
Fe(OH)3(胶体)+3HCl 先有沉淀生成后沉淀消失 负
【解析】
(1)正盐是酸中的氢完全被氢氧根离子中和得到的盐;凡是与碱反应生成盐和水的氧化物是酸性氧化物。
(2)向沸水中滴加少量饱和氯化铁溶液,继续煮沸至液体呈透明红褐色,即得到氢氧化铁胶体;向胶体中加入电解质溶液发生聚沉现象,氢氧化铁沉淀能溶于过量硫酸;胶体能发生电泳。
(1)①纯碱是碳酸钠,是碳酸中的氢完全被氢氧化钠中和的产物,属于正盐;②Mn2O7是酸性氧化物;③硫酸属于酸;④CaO能与酸反应生成盐和水,属于碱性氧化物;⑤CO2与碱反应生成盐和水,属于酸性氧化物;⑥小苏打是碳酸氢钠,是碳酸中的氢部分被氢氧化钠中和的产物,属于酸式盐;⑦K2SO3是亚硫酸中的氢完全被氢氧化钾中和的产物,属于正盐;⑧SO2与碱反应生成盐和水,属于酸性氧化物;⑨Na2O2属于过氧化物;⑩CO不能与酸反应、也不能与碱反应,属于不成盐氧化物;则属于正盐的是①纯碱、⑦K2SO3;属于酸性氧化物的是②Mn2O7、⑤CO2、⑧SO2;
(2)向沸水中滴加少量饱和氯化铁溶液,继续煮沸至液体呈透明红褐色,即得到氢氧化铁胶体,反应方程式是FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl;向胶体中加入电解质溶液发生聚沉现象,氢氧化铁沉淀能溶于过量硫酸,取少量Fe(OH)3胶体于试管中,逐滴加入硫酸至过量,可看到的现象是先有沉淀生成后沉淀消失;将橘红色的硫化锑(Sb2S3)胶体,装入U形管,插入电极后通直流电,发现阳极附近橘红色加深,证明Sb2S3胶粒带负电荷。
Fe(OH)3(胶体)+3HCl;向胶体中加入电解质溶液发生聚沉现象,氢氧化铁沉淀能溶于过量硫酸,取少量Fe(OH)3胶体于试管中,逐滴加入硫酸至过量,可看到的现象是先有沉淀生成后沉淀消失;将橘红色的硫化锑(Sb2S3)胶体,装入U形管,插入电极后通直流电,发现阳极附近橘红色加深,证明Sb2S3胶粒带负电荷。


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】(1)同温同压下,同体积的甲烷(CH4)和二氧化碳物质的量之比为__________,原子总数之比为__________,密度之比为__________。
(2)在标准状况下,4 g H2、11.2 L O2、1 mol H2O中,所含分子数最多的是__________,含原子数最多的是__________,质量最大的是__________,体积最小的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述错误的是
A. 17gH2O2所含非极性键数目为0.5NA
B. 标准状况下,H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA
C. 100gCaS和CaSO4的混合物中含有32g硫,则含有的氧原子数为1.75NA
D. n(H2CO3)和n(HCO3)之和为1mol的 NaHCO3溶液中,含有Na+数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组研究溶液中AgNO3和Na2S的反应。
实验 | 试剂 | 现象 | |
| 试管 | 滴管 | |
(pH = 4) |
(pH = 9) | 出现黑色沉淀 | |
(1)用离子方程式解释Na2S溶液pH > 7的原因:________。
(2)实验小组同学认为黑色沉淀中可能含有Ag2O、Ag2S或Ag,设计实验验证。
已知:i.浓硝酸能将Ag2S转化为![]() 和
和![]() ;
;
ii.Ag2O能溶解在浓氨水中形成银氨溶液,而Ag2S和Ag均不能。
① 设计并实施如下实验,证实沉淀中含有Ag2S。

试剂1和试剂2分别是_________、_________。
现象1和现象2分别是_________、_________。
② 设计并实施如下实验,证实沉淀中不含有Ag2O,将实验操作和现象补充完整。
实验操作 | 实验现象 | |
步骤i | 取少量银氨溶液,向其中滴加盐酸 | 出现白色沉淀 |
步骤ii | 取少量洗涤后的黑色沉淀,____________ | ____________ |
③ 经检验,沉淀不含有Ag。

(3)实验小组同学认为AgNO3溶液具有氧化性,在一定条件下能够氧化Na2S,设计实验进行研究(实验装置如右图所示),测得电压为a(![]() )。
)。
对AgNO3溶液中氧化![]() 的物质进行推测:
的物质进行推测:
假设1: ![]() 的AgNO3溶液中
的AgNO3溶液中![]() 氧化了
氧化了![]() ;
;
假设2: ![]() 的AgNO3溶液中
的AgNO3溶液中![]() 氧化了
氧化了![]() 。
。
利用右图装置继续研究(已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大)。
① 将![]() 的AgNO3溶液替换为_______溶液,记录电压为b(
的AgNO3溶液替换为_______溶液,记录电压为b(![]() )。
)。
② 上述实验证实了氧化![]() 的物质中一定包含
的物质中一定包含![]() ,其证据是______。
,其证据是______。
实验结论:AgNO3溶液与Na2S溶液的反应类型与反应条件有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g) ===2HF(g) ΔH=-270 kJ·mol-1。下列说法正确的是
A. 在相同条件下,1 mol H2(g)与1 mol F2(g)的能量总和小于2 mol HF(g)的能量
B. 1 mol H2(g)与1 mol F2(g)反应生成2 mol液态HF放出的热量大于270 kJ
C. 该反应的逆反应是放热反应
D. 该反应过程的能量变化可用下图来表示

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。该电池工作时的总反应为: NH3·BH3+ 3H2O2= NH4BO2+ 4H2O.下列说法正确的是( )

A. 负极附近溶液的PH增大
B. 正极的反应式为:H2O2+ 2H++2e-=2H2O
C. 电池工作时,BO2-通过质子交换膜向正极移动
D. 消耗3.lg氨硼烷,理论上转移0.2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚氮(N2O)是一种强温室气体,且易转换成颗粒污染物。研究氧化亚氮分解对环境保护有重要意义。
(1)污水生物脱氮过程中,在异养微生物催化下,硝酸铵可分解为N2O和另一种产物,该反应的化学方程式为________。
(2)已知反应2N2O(g)=2N2(g) + O2(g)的ΔH= –163 kJ·mol-1,1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收945 kJ、498 kJ的能量,则1molN2O(g)分子中化学键断裂时需要吸收的能量为________ kJ。
(3)在一定温度下的恒容容器中,反应2N2O(g)=2N2(g) + O2(g)的部分实验数据如下:
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
C(N2O)/mol/L | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.010 |
①在0~20min时段,反应速率v(N2O)为________ mol·L-1·min-1。
②若N2O起始浓度c0为0.150 mol·L-1,则反应至30min时N2O的转化率α =__________。比较不同起始浓度时N2O的分解速率:v(c0=0.150 mol·L-1) ________ v(c0=0.100 mol·L-1)(填“>”、“=”或“<”)。
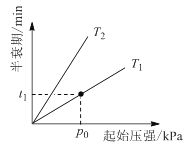
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1________T2(填“>”、“=”或“<”)。当温度为T1、起始压强为p0,反应至t1 min时,体系压强p =________(用p0表示)。
(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步 I2(g) ![]() 2I(g) (快反应)
2I(g) (快反应)
第二步 I(g)+N2O(g)→N2(g)+IO(g) (慢反应)
第三步 IO(g)+N2O(g)→N2(g)+O2(g)+I(g) (快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是________(填标号)。
A.N2O分解反应中,k(含碘)> k(无碘) B.第一步对总反应速率起决定作用
C.第二步活化能比第三步大 D.I2浓度与N2O分解速率无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)CO2经过催化氢化合成低碳烯烃.其合成乙烯的反应为2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
物质 | H-H | C=O | C=C | C-H | H-O |
能量/kJmol-1 | 436 | 745 | 615 | 413 | 463 |
则△H=_____________________。
(2)工业上常用电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为2:1。

①气体甲的化学式____________ 。
②a极与电源的____________ (填“正极”或“负极”)相连,该电极反应式为_______________。
③离子交换膜d为________(填“阴离子”或“阳离子”)交换膜。
④产物丙为_________ 溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A. 向明矾溶液中加入足量的烧碱溶液: Al3+ + 3OH-= Al(OH)3↓
B. 在含有等物质的量的Fe(NO3) 2和KI组成的混合溶液中滴入稀盐酸:3Fe2+ + 4H+ + NO3-=3Fe3+ + NO↑ + 2H2O
C. 碳酸氢铵溶液中滴加足量的NaOH溶液:HCO3-+ OH-= CO32- + H2O
D. 纯碱溶液呈碱性的原因:CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com