
【题目】某实验小组研究溶液中AgNO3和Na2S的反应。
实验 | 试剂 | 现象 | |
| 试管 | 滴管 | |
(pH = 4) |
(pH = 9) | 出现黑色沉淀 | |
(1)用离子方程式解释Na2S溶液pH > 7的原因:________。
(2)实验小组同学认为黑色沉淀中可能含有Ag2O、Ag2S或Ag,设计实验验证。
已知:i.浓硝酸能将Ag2S转化为![]() 和
和![]() ;
;
ii.Ag2O能溶解在浓氨水中形成银氨溶液,而Ag2S和Ag均不能。
① 设计并实施如下实验,证实沉淀中含有Ag2S。

试剂1和试剂2分别是_________、_________。
现象1和现象2分别是_________、_________。
② 设计并实施如下实验,证实沉淀中不含有Ag2O,将实验操作和现象补充完整。
实验操作 | 实验现象 | |
步骤i | 取少量银氨溶液,向其中滴加盐酸 | 出现白色沉淀 |
步骤ii | 取少量洗涤后的黑色沉淀,____________ | ____________ |
③ 经检验,沉淀不含有Ag。

(3)实验小组同学认为AgNO3溶液具有氧化性,在一定条件下能够氧化Na2S,设计实验进行研究(实验装置如右图所示),测得电压为a(![]() )。
)。
对AgNO3溶液中氧化![]() 的物质进行推测:
的物质进行推测:
假设1: ![]() 的AgNO3溶液中
的AgNO3溶液中![]() 氧化了
氧化了![]() ;
;
假设2: ![]() 的AgNO3溶液中
的AgNO3溶液中![]() 氧化了
氧化了![]() 。
。
利用右图装置继续研究(已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大)。
① 将![]() 的AgNO3溶液替换为_______溶液,记录电压为b(
的AgNO3溶液替换为_______溶液,记录电压为b(![]() )。
)。
② 上述实验证实了氧化![]() 的物质中一定包含
的物质中一定包含![]() ,其证据是______。
,其证据是______。
实验结论:AgNO3溶液与Na2S溶液的反应类型与反应条件有关。
【答案】 S2- + H2O ![]() HS- + OH- 浓硝酸 Ba(NO3)2溶液 黑色沉淀溶解,有红棕色气体生成 生成白色沉淀 加入浓氨水,过滤后,向滤液中滴加盐酸 滴加盐酸后,无明显现象 pH=4的
HS- + OH- 浓硝酸 Ba(NO3)2溶液 黑色沉淀溶解,有红棕色气体生成 生成白色沉淀 加入浓氨水,过滤后,向滤液中滴加盐酸 滴加盐酸后,无明显现象 pH=4的![]() NaNO3溶液 a>b
NaNO3溶液 a>b
【解析】(1)Na2S溶液,因硫离子水解而使其显碱性,故其pH > 7,离子方程式为S2- + H2O ![]() HS- + OH-。
HS- + OH-。
(2)①由题中信息可知,浓硝酸能将Ag2S转化为![]() 和
和![]() ,所以可以向黑色沉淀中加入足量的浓硝酸,黑色沉淀溶解后,向溶液中加入硝酸钡溶液,生成白色沉淀,证明黑色沉淀中含有Ag2S。因此,试剂1和试剂2分别是浓硝酸、Ba(NO3)2溶液;现象1和现象2分别是黑色沉淀溶解并有红棕色气体生成、生成白色沉淀。
,所以可以向黑色沉淀中加入足量的浓硝酸,黑色沉淀溶解后,向溶液中加入硝酸钡溶液,生成白色沉淀,证明黑色沉淀中含有Ag2S。因此,试剂1和试剂2分别是浓硝酸、Ba(NO3)2溶液;现象1和现象2分别是黑色沉淀溶解并有红棕色气体生成、生成白色沉淀。
② 根据题中信息可知,Ag2O能溶解在浓氨水中形成银氨溶液,而Ag2S和Ag均不能。因此,可以设计并实施如下对比实验,证实沉淀中不含有Ag2O,实验操作和现象如下表:
实验操作 | 实验现象 | |
步骤i | 取少量银氨溶液,向其中滴加盐酸 | 出现白色沉淀 |
步骤ii | 取少量洗涤后的黑色沉淀,加入浓氨水,过滤后,向滤液中滴加盐酸 | 滴加盐酸后,无明显现象 |
③ 经检验,沉淀不含有Ag。
(3)① 根据控制变量法的原理,将![]() 的AgNO3溶液替换为pH=4的
的AgNO3溶液替换为pH=4的![]() NaNO3溶液,记录电压为b(
NaNO3溶液,记录电压为b(![]() )。
)。
② 由题意知,若a>b,说明![]() 的AgNO3溶液的氧化性强于pH=4的
的AgNO3溶液的氧化性强于pH=4的![]() NaNO3溶液。因此,上述实验证实了氧化
NaNO3溶液。因此,上述实验证实了氧化![]() 的物质中一定包含
的物质中一定包含![]() ,其证据是a>b。
,其证据是a>b。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】现用物质的量浓度为0.100 0 mol·L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:

(1)用标准NaOH溶液滴定时,应将标准NaOH溶液注入_______(填“甲”或“乙”)中。
(2)某学生的操作步骤如下:
A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴部分充满溶液;
D.取标准NaOH溶液注入碱式滴定管至“0”刻度以上 2~3 mL;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是____→___→___→___→A→___(用字母序号填写)。判断到达滴定终点的实验现象是_____________________________________
(3)右上图是碱式滴定管中液面在滴定前后的读数, c(HCl)=_______ mol·L-1。
(4)由于错误操作,使得上述所测盐酸溶液的浓度偏高的是________(填字母)。
A.中和滴定达终点时俯视滴定管内液面读数
B.酸式滴定管用蒸馏水洗净后立即取用25.00 mL待测酸溶液注入锥形瓶进行滴定
C.碱式滴定管用蒸馏水洗净后立即装标准溶液来滴定
D.用酸式滴定管量取待测盐酸时,取液前有气泡,取液后无气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能量是国民经济发展的重要基础,天然气是我国目前使用的主要能源。
(1)已知
化学键 | C-H | C=O | O=O | H-O |
E/(KJ/mol) | a | b | c | d |
CH4(g)+2O2(g)=CO2(g)+2H2O(g)的焓变ΔH=______kJ/mol。
(2)燃料电池具有高的发电效率,因而受到重视。下图甲为甲烷燃料电池(电解质溶液为硫酸)该电池的正极反应为_________。
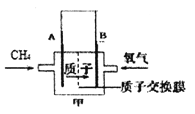
(3)利用上述燃料电池,按下图所示装置进行电解,A、B、C、D均为铂电极,
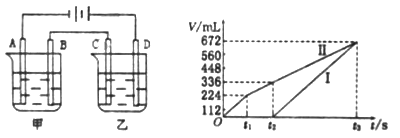
I.甲槽中有200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如上图所示(气体体积已换算成标准状况下的体积),(电解前后溶液的体积变化关系忽略不计)
①原混合溶液中NaCl的物质的量浓度__________mol/L。
②t2时所得溶液的pH=________。
Ⅱ.乙槽中为足量的AgNO3溶液。则阳极反应为__________。t3时电解结束,为了使溶液恢复原样,则可以在反应后的溶液中加入______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂海水电池常用在海上浮标等助航设备中,其示意图如图所示。电池反应为2Li+2H2O===2LiOH+H2↑。电池工作时,下列说法错误的是( )

A. 金属锂作负极
B. 电子从锂电极经导线流向镍电极
C. 可将电能转化为化学能
D. 海水作为电解质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列填空
(1) 2-溴丙烷的消去反应(化学方程式)______________________________________;
(2) 1,2-二溴乙烷的水解(化学方程式)_______________________________________;’
(3)二氢香豆素( )常用作香豆素的替代品,鉴别二氢香豆素和它的一种同分异构体(
)常用作香豆素的替代品,鉴别二氢香豆素和它的一种同分异构体( )需要用到的试剂有:NaOH溶液、_________________;
)需要用到的试剂有:NaOH溶液、_________________;
(4)某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢原子。则A的结构简式为______________________;A是否存在顺反异构体?________ (填“是”或者“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】席夫碱类化合物G在催化、药物、新材料等方面有广泛应用。合成G的一种路线如下:
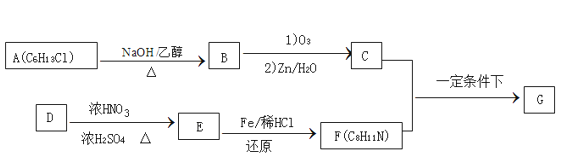
已知以下信息:
①
②1 mol B经上述反应可生2 mol C,且C不能发生银镜反应
③D属于单取代芳烃,其相对分子质量为106
④核磁共振氢谱显示F苯环上有两种化学环境的氢
⑤![]()
回答下列问题:
(1)由A生成B的反应类型为____________
(2)D的化学名称是____________,由D生成E的化学方程式为: ______
(3)G的结构简式为____________
(4)F的同分异构体中含有苯环的还有____种(不考虑立体异构)。其中核磁共振氢谱中有4组峰,且面积比为6:2:2:1的是_______。(写出其中的一种的结构简式)。
(5)由苯和化合物C经如下步骤可合成N-异丙基苯胺。

反应条件1所选择的试剂为__________;反应条件2所选择的试剂为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 1 mol NaHSO4熔融或溶于水时电离出的离子总数均为3NA
B. 17 g H2O2含有0.5NA个非极性共价键
C. 在1L0.5mol/LH2SO4溶液中,含有的氧原子数为2NA
D. 标准状况下,22.4 L Cl2溶于水转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用新方案和新工艺处理废旧铅酸蓄电池,可以达到节能减排、防治污染和资源循环利用的目的。一种处理铅酸蓄电池的流程如下:

已知:Ksp(PbSO4)=1.6×10-8)和Ksp(PbCO3)=7.4×10-14
(1)写出铅酸蓄电池放电时的总反应____________________________________________;
(2)废旧电池的预处理时需要将电池放电完全,目的是____________________________;
(3)写出铅膏脱硫时的离子方程式____________________________________________。
(4)传统的铅蓄电池的处理工艺是将电池破碎后,洗涤,干燥,直接送入回转炉熔炼。而该工艺使用纯碱脱硫的显著优点是________________________________________。
(5)从Na2SO4溶液中结晶出Na2SO4·10H2O晶体的方法是蒸发浓缩、___________、过滤洗涤,洗涤时用乙醇洗涤晶体,用乙醇而不用水洗涤的原因是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Se是制光电池的一种原料。电解铜的阳极泥中含有3%-14%的Se元素(Se元素以Se单质和Cu2Se的形式存在),还含有稀有金属及贵金属。从阳极泥中提取Se的流程如下:
![]()
请回答下列向题:
(1)浓硫酸溶解Cu2Se生成CuSO4、SO2、SeO2的化学方程式为__________________。
(2)流程②的目的是_____________________。
(3)流程④的操作名称是_____________________。
(4)SO2与SeO2(g)反应的离子方程式为________________。根据上述提取Se的工艺流程可知,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是_____________。
(5)工业提取Se的流程中,可循环利用的物质是________________。(填化学式)
(6)①称取5.000g电解铜阳极泥样品。以合适方法溶解,配成250.0mL混酸溶液
②移取上述溶液25.00mL于锥形瓶中,加入30.0mL0.0100mol/LKMnO4标准溶液(Se由+4价转化为+6价)。
③反应完全后,用0.05000mol/L(NH4)2Fe(SO4)2标准溶液滴至终点,消耗(NH4)2Fe(SO4)2标准溶液10.00mL。
则电解铜阳极泥样品中Se的质量分数为__________________。若用FeCl2标准溶液代替(NH4)2Fe(SO4)2标准溶液进行滴定,对测定Se的质量分数结果__________(其“偏高”或“偏低”“ 无影响”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com