
【题目】三氯化硼的熔点为-107.3 ℃,沸点为12.5 ℃,易水解生成硼酸(H3BO3),可用于制造高纯硼、有机合成催化剂等。实验室制取三氯化硼的原理为B2O3+3C+3Cl2![]() 2BCl3+3CO。
2BCl3+3CO。
(1)甲组同学拟用下列装置制取纯净干燥的氯气(不用收集)。

①装置B中盛放的试剂是__,装置C的作用是___________________。
②装置A中发生反应的离子方程式为 _____________________________。
(2)乙组同学选用甲组实验中的装置A、B、C和下列装置(装置可重复使用)制取BCl3并验证反应中有CO生成。

①乙组同学的实验装置中,依次连接的合理顺序为
A→B→C→G→__→__→__→__→F→D→I。
②能证明反应中有CO生成的现象是___________________________。
③开始实验时,先点燃____(填“A” 或“G”)处的酒精灯。
④请写出BCl3水解的化学方程式__________________________。
⑤硼酸是一元弱酸,其钠盐化学式为Na [B(OH)4],则硼酸在水中电离方程式是____。
【答案】 饱和食盐水 干燥氯气 2Mn+16H++10Cl-![]() 2Mn2++5Cl2↑+8H2O E H J H 装置F中黑色粉末变为红色,装置D中澄清石灰水变浑浊 A BCl3+3H2O=H3BO3+3HCl H3BO3+H2O
2Mn2++5Cl2↑+8H2O E H J H 装置F中黑色粉末变为红色,装置D中澄清石灰水变浑浊 A BCl3+3H2O=H3BO3+3HCl H3BO3+H2O![]() [B(OH)4〕-+H+
[B(OH)4〕-+H+
【解析】(1)根据实验装置图可知,用高锰酸钾与浓盐酸反应制得氯气,同时生成氯化钾和氯化锰,制得的氯气中含有氯化氢和水杂质,要用饱和食盐水除去氯化氢,用浓硫酸除去水份,而得到干燥纯净的氯气;
①根据上面的分析可知,装置B中盛放的试剂是饱和食盐水,装置C中装有浓硫酸,其作用是干燥氯气;
②装置A中高锰酸钾与浓盐酸反应制得氯气,同时生成氯化钾和氯化锰,发生反应的离子方程式为 2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(2)乙组同学选用甲组实验中的装置A、B、C制得干燥的氯气,用氯气与B2O3、C反应生成三氯化硼和CO,三氯化硼的熔点为-107.3℃,沸点为12.5℃,所以收集三氯化硼要用冰水冷却,未反应的氯气尾气用氢氧化钠吸收,三氯化硼易水解,为防止氢氧化钠溶液中水进入装置E,在E和J之间接上H装置,用于吸水,生成的CO经干燥后再通过F装置还原氧化铜,再将生成的气体通过澄清石灰水检验,可以证明原反应中有一氧化碳生成,多余的CO不能排放到空气中,要用排水法收集;
①根据上面的分析可知,乙组同学的实验装置中,依次连接的合理顺序为A→B→C→G→E→H→J→H→F→D→I;
②根据实验的原理可知,生成的CO能将黑色的氧化铜还原为红色的铜,同时产生能使澄清石灰水变浑的气体,所以能证明反应中有CO生成的现象是装置F中黑色粉末变为红色,装置D中澄清石灰水变浑浊,;
③加热CuO前需要利用CO除去装置内空气,则开始实验时,先点燃A处的酒精灯;
④BCl3水解生成硼酸和氯化氢的化学方程式为BCl3+3H2O=H3BO3+3HCl;
⑤根据硼酸是一元弱酸,且其钠盐化学式为Na [B(OH)4],可知硼酸在水中电离方程式是H3BO3+H2O![]() [B(OH)4〕-+H+。
[B(OH)4〕-+H+。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】已知:锂离子电池的总反应为:LixC+Li1-xCoO2![]() C+LiCoO2锂硫电池的总反应为: 2Li+S
C+LiCoO2锂硫电池的总反应为: 2Li+S![]() Li2S。有关上述两种电池说法正确的是( )
Li2S。有关上述两种电池说法正确的是( )

A. 锂离子电池放电时,Li+向负极迁移
B. 理论上两种电池的比能量相同
C. 锂硫电池充电时,锂电极发生还原反应
D. 右图表示用锂离子电池给锂硫电池充电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某加碘食盐包装袋上的配料表和部分图表文字(I为碘的元素符号)

(1)由此得到的信息和作出的推测正确的是_______________
A.此食盐是非电解质
B. “菜未烧熟不宜加入加碘盐”的原因可能是碘酸钾受热不稳定
C. 1 kg 此食盐中含碘酸钾(35±15 ) mg
D. “加碘食盐”中的“碘”是指碘单质
E.在食盐中不加入KI的原因可能是能被氧化
(2)已知碘元素最高和最低价分别为一1和+7价,则IO3-在氧化还原中____________(填序号)。
①只能做氧化剂 ② 只能做还原剂 ③ 既可以做氧化剂也可以做还原剂
(3)根据以下化学方程式写出离子方程式:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O__________________;该反应中氧化产物和还原产物的质量比为_________;若生成152.4gI2,转移的电子数为_________;根据以上反应推测,一个氧化还原反应的发生,除了跟物质的氧化性和还原性有关,还和____________有关。
(4)要利用(3)提供的反应原理检验食盐中的碘元素,采用下列方法:
①反应后加入________溶液,溶液变蓝;
②反应后溶液放入试管中加入少量CC14 震荡后静置,若下层显_______色,证明有I2生成。
③ 家庭条件下证明在食盐中存在IO3-进行上述实验时必须使用的物质是________。
a.自来水 b.蓝色石蕊试纸 c.碘化钾淀粉试纸 d.淀粉 e.食糖 f.食醋 g.白酒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是合成某聚酯的路线示意图:请根据信息回答下列问题:


已知:
(1)A的产量用来衡量一个国家石油化工水平,其电子式为__________________
(2)C中所含官能团的名称为__________________________
(3)合成路线中的③、⑥两个步骤的目的是___________________________________ 。
(4)反应⑤的化学方程式为____________________________________________________。
(5)若X为银氨溶液,则反应⑦的化学方程式为 ___________________。
(6)同时符合下列条件的G的同分异构体共有_____________种。
a.既可发生银镜反应又可发生水解反应
b.能与FeCl3溶液发生显色反应
c.是苯的二取代物
上述同分异构体中,核磁共振氢谱有6组峰的结构简式 _____________。 (任写一种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以芳香烃A为原料合成有机物F和I的合成路线如下:
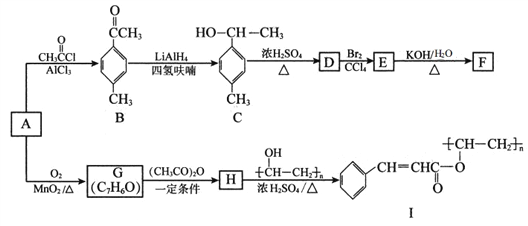
(1)A的分子式为____________,上述八个反应中,属于取代反应的共有_______个。
(2) D的名称为____________________,G分子中最多有_________个原子共面。
(3)由H生成I的化学方程式为_____________________________________________。
(4)符合下列条件的B的同分异构体有____________种(不考虑立体异构),其中核磁共振氢谱为4组峰,且面积比为6:2:1:1的是_________(写出其中一种的结构简式)。
①属于芳香化合物;②能发生银镜反应。
(5)己知![]() ,参照上述合成路线,以苯和丙酸为原料(无机试剂任选),设计制备
,参照上述合成路线,以苯和丙酸为原料(无机试剂任选),设计制备 ![]() 的合成路线___________________________________。
的合成路线___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A. SO2能使FeCl3、酸性KMnO4溶液迅速褪色
B. 可以用澄清石灰水来鉴别SO2与CO2
C. 硫粉在过量的纯氧中燃烧可以生成SO3
D. 少量SO2通入浓的CaCl2溶液中可以生成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤制合成天然气是煤气化的一种重要方法,其工艺核心是合成过程中的甲烷化,涉及的主要反应:
CO(g)+3H2(g)![]() CH4(g)+H2O(g) ΔH<0 ①
CH4(g)+H2O(g) ΔH<0 ①
CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) ΔH<0 ②
CH4(g)+2H2O(g) ΔH<0 ②
现在300 ℃、容积为2 L的密闭容器中进行有关合成天然气的实验,相关数据记录如下:
CO/mol | CO2/mol | H2/mol | CH4/mol | H2O/mol | |
0 min | 4 | 3 | 40 | 0 | 0 |
30 min | 2 | 2 | a | 3 | |
70 min | 1 | b | c | d | 6 |
下列有关说法错误的是
A.a=30,b=1.5
B.c=25,d=4.5
C.前30 min内,反应①的平均反应速率v(CH4)=0.05 mol·L1·min1
D.后40 min内,反应②的平均反应速率v(H2)=0.025 mol·L1·min1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com