
【题目】溶液pH对含有碳杂质的金属铝的腐蚀影响关系如下图,下列说法正确的是

A. 金属铝在Na2CO3稀溶液中腐蚀严重
B. 电解液的pH=9.5时,可发生原电池反应,负极反应为Al-3e-=Al3+
C. 可用电解法在金属铝表面生成保护膜,其原理为2A1+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
D. 铝制餐具应该经常打磨以保持餐具光亮如新
科目:高中化学 来源: 题型:
【题目】恒温下,将a mol N2和b mol H2按一定比例混合,在相同状况下其密度是H2的 3.6倍,取5mol该混合气体通入密闭容器内,使之发生反应并在一定条件下达到平衡。已知反应达到平衡后容器内压强是相同条件下反应前压强的0.92倍,试求:
(1)反应前混合气体中N2和 H2的体积比a﹕b=__________;
(2)达到平衡时混合气体中的H2、NH3的物质的量分别是_____mol、_____mol;
(3)平衡时N2的转化率[n转化(N2)与n初始(N2)之比]________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生以铁丝和Cl2为原料进行下列三个实验.从分类角度分析,下列选项正确的是( ) 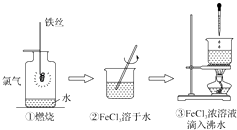
A.实验①、②所涉及的物质均为电解质
B.实验②、③均为放热反应实验
C.②、③均未发生氧化还原反应
D.实验①、③反应制得的物质均为纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: ①1mol晶体硅中含有2molSi-Si键。②Si(s)+O2(g)=SiO2(s)ΔH,其反应过程与能量变化如图所示。
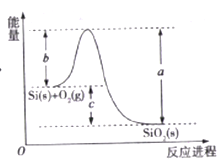
③
化学键 | Si-O | O=O | Si-Si |
断开1mol共价键所需能量/KJ | 460 | 500 | 176 |
下列说法正确的是
A. 晶体硅光伏发电是将化学能转化为电能的
B. 二氧化硅稳定性小于硅的稳定性
C. ΔH=-988 kJ/mol
D. ΔH=a-c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的分类正确的是
纯净物 | 混合物 | 电解质 | 酸性氧化物 | |
A | 高锰酸钾 | 空气 | 醋酸钠 | CO2 |
B | 硝酸 | 矿泉水 | 氯化铵 | H2S |
C | 盐酸 | 水银 | 纯碱 | Cl2O |
D | 氯化钠 | 豆浆 | 铜 | N2O5 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HNO2是一种弱酸,且不稳定,易分解生成 NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成 Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)人体正常的血红蛋白含有 Fe2+。若误食亚硝酸盐(如NaNO2 ),则导致血红蛋白中的 Fe2+转化为 Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是_________(填序号)。
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将 Fe3+还原为 Fe2+ D.亚硝酸盐是还原剂
(2)下列方法中,能用来区分NaNO2和NaCl的是_____(填序号)。
A.分别溶于水看溶解情况
B.在酸性条件下加入KI—淀粉溶液来区别
C.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和 HCl,请写出反应的离子方程式:____________________________________。
(4)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是______(填序号)。
a.Cl2 b.Fe c.H2O2 d.HNO3
(5)若FeSO4和O2的化学计量数比为 2∶1,试配平下列方程式:________________
![]() .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com