
【题目】天宫二号空间实脸室己于2016年9月15日22时04分在酒泉卫星发射中心发射成功。请回答下列问题:
(1)耐辐照石英玻璃是航天器姿态控制系统的核心元件。石英玻璃的成分是___________,该物质的属于_______ 氧化物 ,实验室中不能用玻璃塞试剂瓶盛KOH溶液,原因是_________________________________(用离子方程式表示)。
(2)联氨(N2H4,无色液体)可用作火箭燃料,其电子式为____________。
(3)太阳能电池帆板是“天宫二号”空间运行的动力湃泉。其性能直接影响到“天宫二号”的运行寿命和可靠性。天宫二号使用的光认太阳能电池,该电池的核心材料是___________,其能量转化方式为____________________。
(4)下面是一个还原过程的反应式:NO3﹣+4H++3e﹣→NO+2H2O,KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质能使上述还原过程发生.
①写出并配平该氧化还原反应的方程式:_________________________________
②反应中若产生0.2mol气体,则转移电子的物质的量是___mol.
【答案】![]() 酸性氧化物
酸性氧化物 ![]()
 , Si 太阳能转化为电能
, Si 太阳能转化为电能 ![]() ═
═![]() 0.6
0.6
【解析】
(1)石英玻璃的成分为二氧化硅,化学式为![]() ,二氧化硅和碱反应生成盐和水属于酸性氧化物,玻璃中含二氧化硅,和碱反应生成的硅酸钠溶液是矿物胶瓶塞和瓶口会粘结在一起,不易打开,反应的离子方程式为:
,二氧化硅和碱反应生成盐和水属于酸性氧化物,玻璃中含二氧化硅,和碱反应生成的硅酸钠溶液是矿物胶瓶塞和瓶口会粘结在一起,不易打开,反应的离子方程式为:![]() ;
;
(2)肼的分子式为![]() ,是氮原子和氢原子形成四个共价键,氮原子和氮原子之间形成一个共价键形成的共价化合物,电子式为:
,是氮原子和氢原子形成四个共价键,氮原子和氮原子之间形成一个共价键形成的共价化合物,电子式为: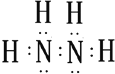 ;
;
(3)天宫二号使用的光伏太阳能电池的核心材料是半导体硅,天宫二号使用的光伏太阳能电池是将太阳能转化为电能;
(4) 还原过程的反应式:![]() ,N元素的化合价降低,则
,N元素的化合价降低,则![]() 为还原剂,即发生硝酸与
为还原剂,即发生硝酸与![]() 的氧化还原反应,由电子守恒及原子守恒可以知道反应式为
的氧化还原反应,由电子守恒及原子守恒可以知道反应式为![]() ═
═![]() ;
;
(5) 由N元素的化合价变化可以知道,若产生0.2mol气体,则转移电子的物质的量是![]() 。
。


科目:高中化学 来源: 题型:
【题目】硫酸的工业制备是一个重要的化工生产过程,但同时在生产过程中会产生大量SO2等污染物。以硫酸工业的尾气、氨水、石灰石、焦炭及氯化钾为原料可以合成有重要用途的硫化钙、硫酸钾、氯化铵、亚硫酸铵等物质。请根据下图中的合成路线回答下列问题:
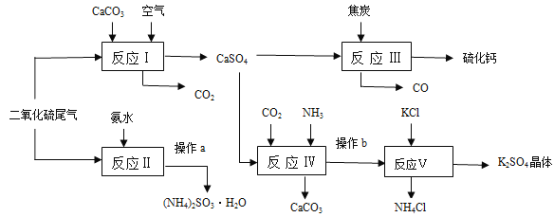
(1)生产中,常向反应II的溶液中加入强还原性的对苯二酚等物质,目的是__________。
(2)操作a中,必须的操作步骤有_______________、___________、过滤等。
(3)反应Ⅲ中氧化剂与还原剂的物质的量之比为__________。
(4)写出反应Ⅳ的化学方程式__________________________________________________;操作b所得滤液中阳离子的检验方法是________________。
(5)该生产过程中可以循环使用的物质是_______________。
(6)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为N2,试写出二氧化氮与亚硫酸铵反应的化学方程式___________________________________________。
(7)某电厂每月用煤300t(煤中含硫的质量分数为2.5%),若燃烧时煤中的硫全部转化为二氧化硫,现用反应Ⅰ的原理将尾气中的SO2转化为石膏[M(CaSO4·2H2O)=172],且反应过程中96%的二氧化硫转化为石膏,则可生产石膏______ t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 lmol碳完全燃烧后可放出393.5KJ的热量,下列热化学方程式正确的是( )
A.C(s)+O2(g)=CO2(g) △H=+393.5kJ/mol
B.C(s)+![]() O2(g)=CO(g) △H=﹣393.5kJ/mol
O2(g)=CO(g) △H=﹣393.5kJ/mol
C.C+O2=CO2 △H=﹣393.5kJ/mol
D.C(s)+O2(g)=CO2(g) △H=﹣393.5kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题:
(1)KIO3的化学名称是_______。
(2)利用“KClO3氧化法”制备KIO3工艺流程如下图所示:

“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是________。“滤液”中的溶质主要是_______。“调pH”中发生反应的化学方程式为__________。
(3)KIO3也可采用“电解法”制备,装置如图所示。
①写出电解时阴极的电极反应式______。
②电解过程中通过阳离子交换膜的离子主要为_________,其迁移方向是_____________。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有______________(写出一点)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴主要以Br- 形式存在于海水(呈弱碱性)中,利用空气吹出法从海水中提溴,工艺流程示意如下。
![]()
资料:常温下溴呈液态,深红棕色,易挥发。
(1)酸化:将海水酸化的主要目的是避免_______(写离子反应方程式)。
(2)脱氯:除去含溴蒸气中残留的Cl2
①具有脱氯作用的离子是_______。
②溶液失去脱氯作用后,补加FeBr2或加入_______,脱氯作用恢复。
(3)富集、制取Br2:
用Na2CO3溶液吸收溴,Br2歧化为BrO3- 和Br-。再用H2SO4酸化歧化后的溶液得到Br2,其离子反应方程式为_______。
(4)探究(3)中所用H2SO4浓度对Br2生成的影响,实验如下:
序号 | A | B | C |
试剂组成 | 1 mol/L NaBr 20% H2SO4 | 1 mol/L NaBr 98% H2SO4 | 将B中反应后溶液用水稀释 |
实验现象 | 无明显现象 | 溶液呈棕红色,放热 | 溶液颜色变得很浅 |
①B中溶液呈棕红色说明产生了_______。
②分析C中溶液颜色变浅的原因,甲同学认为是发生了化学反应所致;乙同学认为是用水稀释所致。若认为甲同学的分析合理,请用具体的反应说明理由;若认为乙同学的分析合理,进一步设计实验方案说明。理由或方案:_______。
③酸化歧化后的溶液宜选用的酸是______(填“稀硫酸”或“浓硫酸”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L容器中三种物质的物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式和反应开始至2 min末Z的平均反应速率分别为( )

A. X+3Y![]() 2Z 0.1 mol/(L·min) B. 2X+Y
2Z 0.1 mol/(L·min) B. 2X+Y![]() 2Z 0.1 mol/(L·min)
2Z 0.1 mol/(L·min)
C. X+2Y![]() Z 0.05 mol/(L·min) D. 3X+Y
Z 0.05 mol/(L·min) D. 3X+Y![]() 2Z 0.05 mol/(L·min)
2Z 0.05 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃以任意比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。下列各组混合烃中不符合此条件的是 ( )
A.CH4 C2H4B.CH4 C3H4C.C2H4 C3H4D.C2H2 C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )
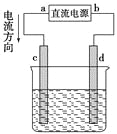
A. a为负极,b为正极
B. a为阳极,b为阴极
C. 电解过程中,d电极质量增加
D. 电解过程中,氯离子浓度不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com