
【题目】目前世界上 60%的镁是从海水中提取的。学生就这个课题展开了讨论。已知海水提镁的主要步骤如下:
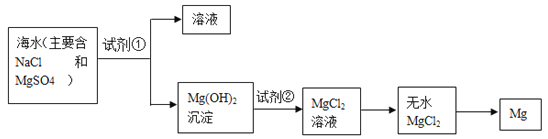
(一)在海水提镁的过程中如何实现对镁离子的富集? 学生提出三个不同观点。
观点 1:直接往海水中加入沉淀剂。
观点 2:高温加热蒸发海水后,再加入沉淀剂。
观点 3:利用晒盐后的苦卤水,再加入沉淀剂。
请你评价三个学生提出的观点是否正确(填是或否),并简述理由。

(二)在海水提镁的过程中如何实现对镁离子的分离?
(1)为了使镁离子沉淀下来,加入的足量试剂①是____________________(填化学式)。
(2)加入的足量试剂②是____________________(填化学式)。
(3)试从节约能源,提高金属镁的纯度分析,以下适宜的冶镁方法是__________。

【答案】(一)
是否正确 | 简述理由 | |
观点1 | 否 | 海水中镁离子浓度小,沉淀剂的用量大,不利于镁离子的沉淀。 |
观点2 | 否 | 能源消耗大,海水的综合利用低,成本高。 |
观点3 | 是 | 镁离子富集浓度高,成本低。 |
(二) (1)Ca(OH)2 (2)HCl (3)c
【解析】
试题分析:(一)学生1与其他观点相比,海水中镁离子浓度小,使用的沉淀剂的量较大,且不利于收集氢氧化镁,因此学生1的观点不正确,原因是海水中镁离子浓度小,沉淀剂的用量大,不利于镁离子的沉淀。学生2与其他观点相比,高温蒸发海水,消耗的能源多,成本太高,因此学生2的观点不正确,原因是能源消耗大,海水的综合利用低,成本高。学生3与学生2相比,利用晒盐后的苦卤,节约能源,成本低;与学生1相比镁离子浓度高,有利于镁元素的富集,因此学生3的观点正确,因为镁离子富集浓度高,成本低。
(二)(1)加入试剂①反应生成氢氧化镁,最好使用氢氧化钠,既生成氢氧化镁又不在剩余溶液中引入其他杂质离子,但从经济效益考虑,要使用氢氧化钙,化学式为Ca(OH)2;
(2)要使氢氧化镁转化为氯化镁,则需要加入盐酸反应,即试剂②是盐酸;
(3)对于a、b来说,制取单质镁,不用电解氧化镁的方法,原因是氧化镁相对氯化镁来说,熔点太高、消耗能源太多,因此a、b均不正确;制取镁时,要把氢氧化镁转化为无水氯化镁,然后电解熔融状态的氯化镁,即d不正确,c正确,答案选c。


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+。现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )
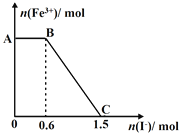
A. 图中AB段的氧化剂为K2Cr2O7
B. 图中BC段发生的反应为2Fe3++2I-=2Fe2++I2
C. 开始加入的K2Cr2O7为0.25 mol
D. K2Cr2O7可与FeSO4反应的物质的量为1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中,通常是加热酒精和浓硫酸的混合物,在170℃时制得乙烯,在这个反应中,浓硫酸起催化剂和脱水剂的作用。
I.参考上述资料,结合已学知识,回答下列问题。
(1)下列说法中不正确的是_____(填序号)
a.一氯乙烯(CH2=CHCl)中六个原子在同一平面上
b.乙烯分子中的碳碳双键是两条相同的碳碳双键
c.长途运输水果时,可用高锰酸钾吸收水果释放的乙烯,以保持水果新鲜
d.除去乙烷中的乙烯,可以选用酸性高锰酸钾溶液
(2)实验室制取乙烯反应的化学方程式是_________________________。
(3)实验室制取的乙烯中混有SO2等气体杂质。下列试剂中,可用于检验乙烯中混有的SO2的是_____。
a.溴水 b.酸性高锰酸钾溶液 c.品红溶液
Ⅱ.已知乙烯能发生以下转化:
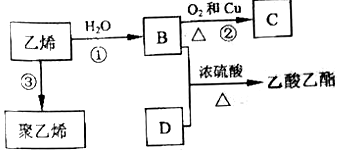 请填空
请填空
(1)B物质所含官能团的名称是_________________________。
(2)反应②的化学方程式是________________________。
(3)B和D的反应装置如图所示。
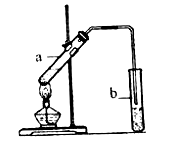
写出实验室制取乙酸乙酯的化学方程式是_______________,反应类型是 _____________。
(4)试管b中盛放的试剂是___________溶液,试管b导气管的下端不能插入液面以下,其目的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业中,常用氯化铁溶液作为印刷电路铜板蚀刻液。请按要求回答下列问题:
(1)若向氯化铁溶液中加入一定量的澄清石灰水,调节溶液pH,可得红褐色沉淀,该反应的离子方程式为:______________________________________,该过程中调节溶液的pH为5,则c(Fe3+)为:____________mol·L-1。(己知:Ksp[Fe(OH)3]= 4.0×10-38)
(2)某探究小组设计如下线路处理废液和资源回收:
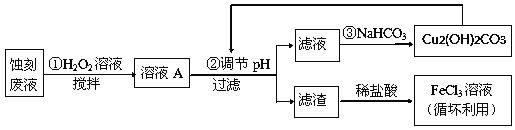
①用足量FeCl3溶液蚀刻铜板后的废液中含有的金属阳离子有:_______________。
②FeCl3蚀刻液中通常加入一定量的盐酸,其中加入盐酸的目的是:_________________。
③步骤①中加入H2O2溶液的目的是:______________________________________。
④已知:生成氢氧化物沉淀的pH
Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 4.7 | 7.0 | 1.9 |
沉淀完全时 | 6.7 | 9.0 | 3.2 |
根据表中数据推测调节pH的范围是:________________。
⑤写出步骤②中生成CO2的离子方程式:__________(已知Cu2(OH)2CO3难溶于水)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知溶液中:还原性HSO3―>I―,氧化性IO3―>I2>>SO32―。向含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如下图所示,下列说法正确的是

A.a点反应的还原剂是NaHSO3,被氧化的元素是碘元素
B.b点反应的离子方程式是:3HSO3-+IO3-+3OH-=3SO42-+I-+3H2O
C.c点到d点的反应中共转移0.6mol电子
D.往200ml 1mol/LKIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式是:
5HSO3-+2IO3-=I2+5SO42-+3H++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“天宫二号”于2016年9月15日发射成功,是我国科技发展的集中体现。关于能源和材料,下列说法错误的是
A.光导纤维在信息产业中有广泛的应用,制造光导纤维的主要材料是二氧化硅
B.煤的干馏、气化和液化均属于化学变化
C.即将到来的新能源时代,核能、太阳能和氢能等很可能成为主要能源
D.复合材料属于有机分子材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】七水硫酸镁(MgSO47H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣﹣硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 | ||||||
pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 | ||||||
表2 两种盐的溶解度(单位为g/100g水)
温度/℃ | 10 | 30 | 40 | 50 | 60 | ||||||||||||
CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 | ||||||||||||
MgSO47H2O | 30.9 | 35.5 | 40.8 | 45.6 | / | ||||||||||||
硼镁泥制取七水硫酸镁的工艺流程如下:
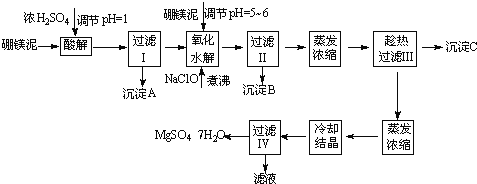
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为 .加热煮沸的主要目的是 。
(2)沉淀B中除MnO2、SiO2外还含有 (填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 。
(4)沉淀C的化学式是 .过滤Ⅲ需趁热过滤的理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将X气体通入BaCl2溶液,未见沉淀生成,然后通入Y气体,有沉淀生成,X、Y不可能是( )
A.SO2 、 H2S B.NH3、 CO2 C.Cl2 、 CO2 D.SO2 、Cl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com