
【题目】在实验室中,通常是加热酒精和浓硫酸的混合物,在170℃时制得乙烯,在这个反应中,浓硫酸起催化剂和脱水剂的作用。
I.参考上述资料,结合已学知识,回答下列问题。
(1)下列说法中不正确的是_____(填序号)
a.一氯乙烯(CH2=CHCl)中六个原子在同一平面上
b.乙烯分子中的碳碳双键是两条相同的碳碳双键
c.长途运输水果时,可用高锰酸钾吸收水果释放的乙烯,以保持水果新鲜
d.除去乙烷中的乙烯,可以选用酸性高锰酸钾溶液
(2)实验室制取乙烯反应的化学方程式是_________________________。
(3)实验室制取的乙烯中混有SO2等气体杂质。下列试剂中,可用于检验乙烯中混有的SO2的是_____。
a.溴水 b.酸性高锰酸钾溶液 c.品红溶液
Ⅱ.已知乙烯能发生以下转化:
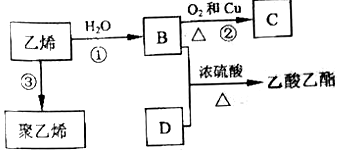 请填空
请填空
(1)B物质所含官能团的名称是_________________________。
(2)反应②的化学方程式是________________________。
(3)B和D的反应装置如图所示。
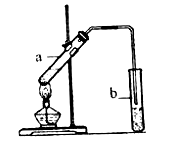
写出实验室制取乙酸乙酯的化学方程式是_______________,反应类型是 _____________。
(4)试管b中盛放的试剂是___________溶液,试管b导气管的下端不能插入液面以下,其目的是_______。
【答案】I.(1)b d ;
(2)CH3CH2OH![]() CH2=CH2↑+H2O;(3)c ;
CH2=CH2↑+H2O;(3)c ;
II.(1)羟基;
(2)2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
(3)CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O取代反应(或酯化反应)
CH3COOCH2CH3+H2O取代反应(或酯化反应)
(4)饱和碳酸钠溶液; 防止倒吸。
【解析】
试题分析:I.(1)a.一氯乙烯(CH2=CHCl)可看作是乙烯分子的H原子被Cl原子取代产生的物质,由于乙烯是平面分子,所以一氯乙烯分子中六个原子在同一平面上,正确;b.乙烯分子中的碳碳双键中两个碳原子结合方式不同,所以不是两条相同的碳碳双键,错误;c.乙烯具有还原性,可以被酸性高锰酸钾溶液氧化为CO2气体,所以长途运输水果时,可用高锰酸钾吸收水果释放的乙烯,以保持水果新鲜,正确;d.除去乙烷中的乙烯,若选用酸性高锰酸钾溶液,乙烯被氧化产生CO2,又混入新的杂质,应该用溴水洗气,错误;(2)实验室是用乙醇与浓硫酸混合加热170℃制取乙烯的,制取乙烯反应的化学方程式是CH3CH2OH![]() CH2=CH2↑+H2O;(3)a.乙烯与SO2都可以使溴水褪色,不能检验,错误;b.乙烯与SO2都可以被酸性高锰酸钾溶液氧化而使溶液褪色,不能用于检验,错误;c.SO2可以使品红溶液褪色,而乙烯不能使其褪色,故可以用品红溶液检验二氧化硫的存在,正确;II.(1)乙烯与水发生加成反应产生的B物质是乙醇,所含官能团的名称是羟基;(2)反应②是乙醇被O2在Cu作催化剂时氧化产生乙醛,反应的化学方程式是2CH3CH2OH+O2
CH2=CH2↑+H2O;(3)a.乙烯与SO2都可以使溴水褪色,不能检验,错误;b.乙烯与SO2都可以被酸性高锰酸钾溶液氧化而使溶液褪色,不能用于检验,错误;c.SO2可以使品红溶液褪色,而乙烯不能使其褪色,故可以用品红溶液检验二氧化硫的存在,正确;II.(1)乙烯与水发生加成反应产生的B物质是乙醇,所含官能团的名称是羟基;(2)反应②是乙醇被O2在Cu作催化剂时氧化产生乙醛,反应的化学方程式是2CH3CH2OH+O2![]() 2CH3CHO+2H2O;(3)乙醇B与乙酸D在浓硫酸存在时,在加热条件下发生酯化反应,产生乙酸乙酯和水,发生反应的化学方程式是:CH3COOH+CH3CH2OH
2CH3CHO+2H2O;(3)乙醇B与乙酸D在浓硫酸存在时,在加热条件下发生酯化反应,产生乙酸乙酯和水,发生反应的化学方程式是:CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O,该反应是酯化反应,也属于取代反应;(4)反应产生乙酸乙酯及未发生反应而挥发的乙酸和乙醇进入盛有饱和碳酸钠溶液的试管b中,试管b导气管的下端不能插入液面以下,其目的是防止乙醇溶解而引起的倒吸现象的发生。
CH3COOCH2CH3+H2O,该反应是酯化反应,也属于取代反应;(4)反应产生乙酸乙酯及未发生反应而挥发的乙酸和乙醇进入盛有饱和碳酸钠溶液的试管b中,试管b导气管的下端不能插入液面以下,其目的是防止乙醇溶解而引起的倒吸现象的发生。


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如下图所示。常温下,S2Cl2遇水易与水发生反应,并产生能使品红褪色的气体,下列说法中错误的是
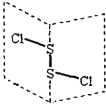
A.S2Cl2的结构式为 Cl—S—S—Cl
B. S2Cl2与水反应时只有S—Cl断裂
C.S2Br2含有极性键和非极性键
D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与化学反应原理相关的叙述不正确的是( )
A.放热反应中生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.盖斯定律实质上是能量守恒定律的体现
D.电离平衡、水解平衡和沉淀溶解平衡均为动态平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产和日常生活中有着重要的应用。下列说法不正确的是( )
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B.在海轮外壳上.镶入锌块,可减缓船体的腐蚀速率
C.MgO的熔点很高,可用于制翻作耐高温材料
D.电解MgCl2饱和溶液,可制得金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】邻羟基桂皮酸是合成香精的重要原料,下为合成邻羟基桂皮酸的路线之一
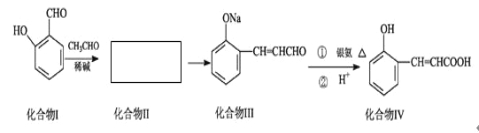
已知:
试回答下列问题:
(1)化合物II的结构简式为: 。
(2)化合物II→化合物III的有机反应类型 。
(3)化合物III在银氨溶液中发生反应化学方程式 。
(4)有机物X为化合物IV的同分异构体,且知有机物X有如下特点:①是苯的对位取代物,②能与NaHCO3反应放出气体,③能发生银镜反应。请写出化合物X的结构简式 。
(5)下列说法正确的是( )
A. 化合物I遇氯化铁溶液呈紫色
B. 化合物II能与NaHCO3溶液反应
C. 1mol化合物IV完全燃烧消耗9.5molO2
D. 1mol化合物III能与3 mol H2反应
(6)有机物R(C9H9ClO3)经过反应也可制得化合物IV,则R在NaOH醇溶液中反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有FeBr2和FeI2的混合溶液中,通入过量的氯气,然后把溶液加热蒸干、灼烧,最后留下的是
①FeCl2②FeCl3③I2④Br2⑤Fe(OH)3⑥Fe2O3⑦FeO
A.①③④
B.③⑦
C.③⑤
D.⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学-选修2:化学与技术】印尼火山喷发不仅带来壮观的美景,还给附近的居民带来物质财富,有许多居民冒着生命危险在底部的火山口收集纯硫磺块来赚取丰厚收入。硫磺可用于生产化工原料硫酸。某工厂用如图所示的工艺流程生产硫酸:

请回答下列问题:
(1)为充分利用反应放出的热量,接触室中应安装 (填设备名称).吸收塔中填充有许多瓷管,其作用是 。
(2)为使硫磺充分燃烧,经流量计1通入燃烧室的氧气过量50%,为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为 。假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为 (空气中氧气的体积分数按0.2计),该尾气的处理方法是 。
(3)与以硫铁矿为原料的生产工艺相比,该工艺的特点是 (可多选)。
A.耗氧量减少 B.二氧化硫的转化率提高 C.产生的废渣减少 D.不需要使用催化剂
(4)硫酸的用途非常广,可应用于下列哪些方面 。
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸钠”的合成 C.铅蓄电池的生产 D.过磷酸钙的制备
(5)矿物燃料的燃烧是产生大气中SO2的主要原因之一.在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前世界上 60%的镁是从海水中提取的。学生就这个课题展开了讨论。已知海水提镁的主要步骤如下:
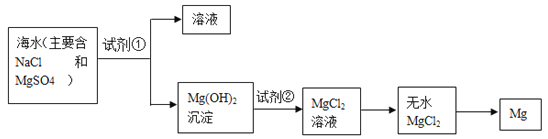
(一)在海水提镁的过程中如何实现对镁离子的富集? 学生提出三个不同观点。
观点 1:直接往海水中加入沉淀剂。
观点 2:高温加热蒸发海水后,再加入沉淀剂。
观点 3:利用晒盐后的苦卤水,再加入沉淀剂。
请你评价三个学生提出的观点是否正确(填是或否),并简述理由。

(二)在海水提镁的过程中如何实现对镁离子的分离?
(1)为了使镁离子沉淀下来,加入的足量试剂①是____________________(填化学式)。
(2)加入的足量试剂②是____________________(填化学式)。
(3)试从节约能源,提高金属镁的纯度分析,以下适宜的冶镁方法是__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法制取有广泛用途的Na2FeO4,同时获得氢气。工作原理如图1所示,c( Na2FeO4)随初始c(NaOH)的变化如图2。
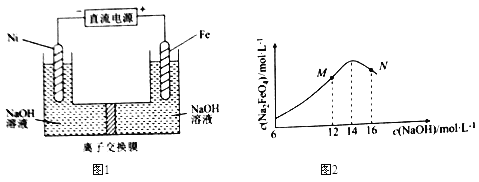
已知:FeO42-为紫红色;Na2FeO4只在强碱性条件下稳定,易被H2还原;溶液中OH-浓度过高,铁电极区会产生红褐色物质。下列说法错误的是( )
A.制备Na2FeO4的电极反应为Fe-6e-+8OH-=FeO42-+4H2O
B.电解过程中,须将阴极产生的气体及时排出
C.MN两点中c(Na2FeO4)低于最高值的原因不同,在M点会有Fe(OH)3生成
D.图1中的离子交换膜为阴离子交换膜,电解过程中,阴极区附近pH会增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com