
【题目】氧化还原反应在生产生活中有着重要的应用。请按要求写出相应的方程式。
(1)将含SO2的废气通入含Fe2+(催化剂)的溶液中,常温下可使SO2转化为SO2-4,其总反应为2SO2+O2+2H2O=2H2SO4。上述总反应分两步进行,第一步反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,写出第二步反应的离子方程式: 。
(2)pH=3.6时,碳酸钙与硫酸铝反应可制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液。若溶液的pH偏高,则碱式硫酸铝产率降低且有气泡产生,用化学方程式表示其原因: 。
(3)ClO2是一种高效安全的杀菌消毒剂。氯化钠电解法生产ClO2工艺原理示意图如下:

①写出氯化钠电解槽内发生反应的离子方程式: 。
②写出ClO2发生器中的化学方程式,并标出电子转移的方向及数目: 。
③ClO2能将电镀废水中的CN-离子氧化成两种无毒气体,自身被还原成Cl-。写出该反应的离子方程式 。
【答案】(1)2Fe3++SO2+2H2O=2Fe2++SO2-4+4H+
(2)3CaCO3+Al2(SO4)3+3H2O=2Al(OH)3↓+3CaSO4↓+3CO2↑
(3)①Cl-+3H2O![]() 3H2↑+ClO
3H2↑+ClO![]()
②![]()
③2ClO2+2CN-=2CO2↑+2Cl-+N2↑
【解析】试题分析:(1)总反应的离子方程式减第一步反应,得第二步反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO2-4+4H+;(2)若溶液的pH偏高,则碱式硫酸铝产率降低且有气泡产生的原因是生成氢氧化铝沉淀,化学方程式为3CaCO3 + Al2(SO4)3 + 3H2O = 2Al(OH)3↓ + 3CaSO4↓ + 3CO2↑;(3)①根据电解原理,氯化钠电解槽内发生反应的离子方程式Cl-+3H2O![]() 3H2↑+ClO
3H2↑+ClO![]() ;②ClO2发生器中氯酸钠被还原为ClO2,盐酸被氧化为氯气,化学方程式
;②ClO2发生器中氯酸钠被还原为ClO2,盐酸被氧化为氯气,化学方程式![]() ;③ClO2能将电镀废水中的CN-离子氧化成两种无毒气体,自身被还原成Cl-。该反应的离子方程式为2ClO2+2CN-=2CO2↑+2Cl-+N2↑。
;③ClO2能将电镀废水中的CN-离子氧化成两种无毒气体,自身被还原成Cl-。该反应的离子方程式为2ClO2+2CN-=2CO2↑+2Cl-+N2↑。


科目:高中化学 来源: 题型:
【题目】(1)已知标准状况下1.505×1023个X气体分子的质量为8g,则X气体的体积为________________,摩尔质量为__________。
(2)用20g烧碱配制成500mL溶液,其物质的量浓度为___________________mol/L;从中取出1mL,其物质的量浓度为______________________mol/L,含溶质________________g;若将这1mL溶液用水稀释到100mL,所得溶液中溶质的物质的量浓度为_____________mol/L,其中含Na+__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物的应用非常广泛。
(1)向FeCl3溶液中加入氨水,离子方程式是_______________________。
(2)在25℃时,Ksp[Fe(OH)3]=4×10-38,向浓度为0.1 molL-1的FeCl3 溶液中逐滴加入氨水,调节溶液pH为5时,溶液中c (Fe3+)为_____________mol/L。
(3)硫酸铁铵[NH4Fe(SO4)2·12H2O]溶液中离子浓度的大小顺序为________________。
(4)FeCl3的质量分数通常可用碘量法测定:称取2.30g无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容; 取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂,并用0.100 molL-1Na2S2O3溶液滴定用去12.50mL。
已知:I2 + 2S2O32-=2I-+ S4O62-
①写出加入稍过量的KI溶液反应的离子方程式:___________________________。
②样品中氯化铁的质量分数为_____________________________(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常状况下,CO是一种无色、无味、有毒的气体,难溶于水,与酸、碱、盐溶液均不反应。酒精喷灯可用作高温热源。正确连接如图所示的装置进行实验,可以验证某混合气体的成分是CO2和CO(每套装置限用一次)。请回答下列问题:
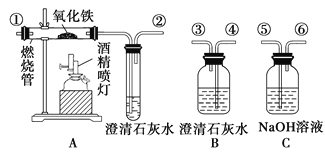
(1)连接装置导管口的顺序:混合气体→__________________→尾气处理(填导管接口代号)。
(2)证明原混合气体中CO2存在的实验现象是__________________________________;
证明CO存在的有关反应的化学方程式是__________________________________________。
(3)有同学提出仪器B应再使用一次,你认为有道理吗?________(填“有”或“没有”),并简述理由:
_________________________________________________________________。
(4)本实验尾气处理的方法是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 由金属元素和非金属元素形成的化合物一定是离子化合物
B. 完全由非金属元素形成的化合物一定是共价化合物
C. 离子化合物中只含有离子键
D. 共价化合物中只含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜,改进氨碱法设计了“联合制碱法”,为世界制碱工业作出了突出贡献.生产流程如图1:

(1)完成有关反应的化学方程式
①沉淀池:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl
②煅烧炉:
(2)联合制碱法的优点表述中,不正确的是
A.生产原料为:食盐、NH3、CO2
B.副产物氯化铵可做氮肥
C.生产过程中可循环利用的物质只有CO2
D.原料利用率高
某实验小组,利用下列装置图2模拟“联合制碱法”的第一步反应.

(3)上述装置中接口连接顺序为 ;
A.a接c;b接f、e接d B.a接d;b接f、e接c
C.b接d;a接e、f接c D.b接c;a接f、e接d
(4)D中应选用的液体为 .
为测定产品纯碱的成分和含量,做如下实验.假设产品纯碱中只含NaCl、NaHCO3杂质.
(5)检验产品纯碱中是否含有NaCl,可取少量试样溶于水后,再滴加 试剂.
(6)滴定法测定纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用c mol/L的HCl溶液滴定至溶液由红色变为无色(指示CO32﹣+H+=HCO3﹣反应的终点),所用HCl溶液体积为V1mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄色变为橙色,所用HCl溶液总体积为V2mL.则纯碱样品中NaHCO3质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q、R六种短周期主族元素,原子序数依次增大,Z基态原子核外有三个未成对电子,Y、Z、W分别与X形成常见化合物的分子结构依次为正四面体、三角锥形和V形,Q的各级电离能如下表,W与R是同族元素。
Q | I1 | I2 | I3 | I4 | I5 | … |
电离能(kJ/mol) | 496 | 4562 | 6912 | 9543 | 13353 | … |
回答下列有关问题:
(1)W原子的价电子排布图为_______________________________。
(2)化合物X 2W2的电子式______________,化合物XYZ的结构式________________。
(3)RW3分子中的键角___________,RW32-分子的立体构型是_______________形。
(4)YW2中的化学键类型为_________共价键(填“极性”或“非极性”),根据等电子原理,指出与YW互为等电子体且含有Z原子的微粒有________(要求写一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式及其叙述正确的是( )
A. 氢气的燃烧热为285.5 kJ·mol·-1,则水分解的热化学方程式为:2H2O(l)=2H2+O2(g)ΔH=+285.5 kJ·mol-1
B. 已知2C(石墨,s)+O2(g)=2CO(g)ΔH=-221 kJ·mol-1,则石墨的燃烧热为110.5 kJ·mol-1
C. 已知N2(g)+3H2(g) ![]() 2NH3(g)ΔH=-92.4 kJ·mol-1,则在一定条件下将1 mol N2和3 mol H2置于一密闭容器中充分反应后最多可放出92.4 kJ的热量
2NH3(g)ΔH=-92.4 kJ·mol-1,则在一定条件下将1 mol N2和3 mol H2置于一密闭容器中充分反应后最多可放出92.4 kJ的热量
D. 已知乙醇和乙烯的燃烧热分别为1 366.8 kJ·mol-1和1 411.0 kJ·mol-1,则乙烯水化制乙醇的热化学方程式为:C2H4(g)+H2O(l)=C2H5OH(l) ΔH=-44.2 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com