
【题目】某实验小组同学模拟工业制碘的方法,探究ClO3﹣和I﹣的反应规律.实验操作及现象如表:
实验及试剂 | 编号 | 无色NaClO3 | 试管中 | 淀粉KI |
| 1 | 0.05 mL | 浅黄色 | 无色 |
2 | 0.20 mL | 深黄色 | 无色 | |
3 | 0.25 mL | 浅黄色 | 蓝色 | |
4 | 0.30 mL | 无色 | 蓝色 |
(1)取实验2后的溶液,进行如图实验: 
经检验,上述白色沉淀是AgCl.写出加入0.20mL NaClO3后,溶液中ClO3﹣和I﹣发生反应的离子方程式: .
(2)查阅资料:一定条件下,I﹣和I2都可以被氧化成IO3﹣ .
作出假设:NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)
中的反应产物继续反应,同时生成Cl2 .
进行实验:
①取少量实验4中的无色溶液进行如图实验,进一步佐证其中含有IO3﹣ . 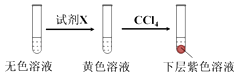
其中试剂X可以是(填字母序号).
a.碘水b.KMnO4溶液c.NaHSO3溶液
②有同学提出,仅通过湿润淀粉KI试纸变蓝的现象不能说明生成Cl2 , 便补充了如下实验:将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30mL 1.33molL﹣1NaClO3溶液后,发现湿润的淀粉试纸没有明显变化.进行以上对比实验的目的是 , 进一步佐证实验4中生成了Cl2 . 获得结论:NaClO3溶液用量增加导致溶液褪色的原因是(用离子方程式表示).
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如表实验结果:
编号 | 6.0 molL﹣1 H2SO4溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
5 | 0.25 mL | 浅黄色 | 无色 |
6 | 0.85 mL | 无色 | 蓝色 |
①对比实验4和5,可以获得的结论是 .
②用离子方程式解释实验6的现象: .
【答案】
(1)ClO3﹣+6I﹣+6H+═Cl﹣+3I2+3H2O
(2)c;排除易升华的I2对湿润淀粉KI试纸检验Cl2的干扰;2ClO3﹣+I2═Cl2↑+2IO3﹣
(3)ClO3﹣和I﹣的反应规律与H+(或H2SO4)的用量有关;6ClO3﹣+5I﹣+6H+═3Cl2↑+5IO3﹣+3H2O
【解析】解:(1)加入0.20mL NaClO3后,溶液颜色变为深黄色,淀粉KI试纸颜色变蓝色,说明氯酸根离子具有氧化性能氧化碘离子为单质碘,反应的离子方程式为:ClO3﹣+6I﹣+6H+═Cl﹣+3I2+3H2O,
所以答案是:ClO3﹣+6I﹣+6H+═Cl﹣+3I2+3H2O;(2)①取少量实验4中的无色溶液进行如图实验,无色溶液中加入试剂X变为黄色,加入四氯化碳萃取得到下层紫红色,说明生成了碘单质,加入的试剂具有还原性,能和碘酸根离子发生氧化还原反应生成碘单质,选择c选项的NaHSO3溶液,a选项含碘单质不能验证,b为高锰酸钾溶液具有氧化性,不符合要求,进一步佐证其中含有IO3﹣ , 所选试剂为c,
所以答案是:c;②将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30mL 1.33molL﹣1NaClO3溶液后,发现湿润的淀粉试纸没有明显变化,说明无碘单质生成,排除易升华的I2对湿润淀粉KI试纸检验Cl2的干扰,NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)中的反应产物继续反应,同时生成Cl2;说明是氯气的氧化性以后碘离子生成了碘单质;NaClO3溶液用量增加导致溶液褪色的原因是氯酸根离子以后碘单质为碘酸根离子,反应的离子方程式为:2ClO3﹣+I2═Cl2↑+2IO3﹣ ,
所以答案是:排除易升华的I2对湿润淀粉KI试纸检验Cl2的干扰;2ClO3﹣+I2═Cl2↑+2IO3﹣;(3)①对比实验5和6,硫酸用量不同试管中溶液颜色不同说明氢离子浓度不同氯酸根离子以后碘离子产物不同,获得的结论是ClO3﹣和I﹣的反应规律与H+(或H2SO4)的用量有关,
所以答案是:ClO3﹣和I﹣的反应规律与H+(或H2SO4)的用量有关;
②实验6的现象是氯酸根离子以后碘离子生成碘酸根,通式生成氯气能使湿润的淀粉KI试纸变蓝色,反应的离子方程式为:6ClO3﹣+5I﹣+6H+═3Cl2↑+5IO3﹣+3H2O,
所以答案是:6ClO3﹣+5I﹣+6H+═3Cl2↑+5IO3﹣+3H2O.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符合的是( ) 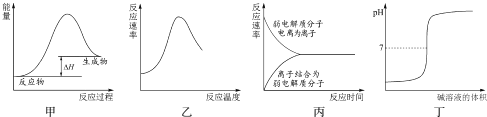
A.图甲表示燃料燃烧反应的能量变化
B.图乙表示酶催化反应的反应速率随反应温度的变化
C.图丙表示弱电解质在水中建立电离平衡的过程
D.图丁表示强碱滴定强酸的滴定曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活息息相关.下列叙述正确的是( )
A.鲜榨橙汁遇到碘水会变蓝
B.馒头越嚼越甜
C.油脂经水解可变成葡萄糖
D.土豆中的淀粉经水解可变成酒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤制天然气工艺是煤高效洁净利用的新途径之一,其工艺流程简如图1如下: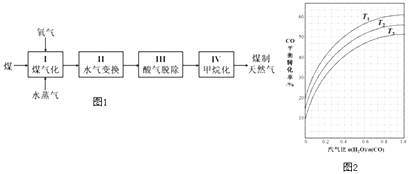
(1)反应I:C(s)+H2O(g)CO(g)+H2(g)△H=+135kJmol﹣1 , 通入的氧气会与部分碳发生燃烧反应.请利用能量转化及平衡移动原理说明通入氧气的作用: .
(2)反应II:CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣41kJmol﹣1 . 如图2表示不同温度条件下,煤气化反应I发生后的汽气比(水蒸气与原料气中CO物质的量之比)与CO平衡转化率的变化关系.
①判断T1、T2和T3的大小关系: .
②若煤气化反应I发生后的汽气比为0.8,经煤气化反应I和水气变换反应II后,得到CO与H2的物质的量之比为1:3,则反应II应选择的温度是(填“T1”“T2”或“T3”).
(3)①甲烷化反应IV发生之前需要进行脱酸反应III.煤经反应I和II后的气体中含有两种酸性气体,分别是H2S和 .
②工业上常用热碳酸钾法脱除H2S气体得到两种酸式盐,该反应的化学方程式是 .
(4)已知:
CO(g)+H2O(g)CO2(g)+H2(g)△H1=﹣41kJmol﹣1
2H2(g)+O2(g)2H2O(g)△H2=﹣484kJmol﹣1
CH4(g)+2O2(g)CO2(g)+2H2O(g)△H3=﹣802kJmol﹣1
反应IV:CO(g)+3H2(g)CH4(g)+H2O(g)△H=
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物.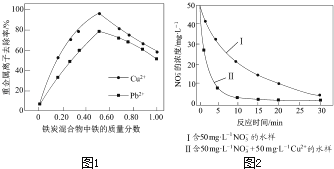
(1)铁炭混合物在水溶液中可形成许多微电池.将含有Cr2O72﹣的酸性废水通过铁炭混合物,在微电池正极上Cr2O72﹣转化为Cr3+ , 其电极反应式为 .
(2)在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图1所示.
①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+ , 其原因是 .
②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是 .
(3)纳米铁粉可用于处理地下水中的污染物.
①一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4﹣(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4﹣ , 其离子方程式为 .
②纳米铁粉与水中NO3﹣反应的离子方程式为:4Fe+NO3﹣+10H+═4Fe2++NH4++3H2O。
研究发现,若pH偏低将会导致NO3﹣的去除率下降,其原因是 .
③相同条件下,纳米铁粉去除不同水样中NO3﹣的速率有较大差异(见图2),产生该差异的可能原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学研究中,往往可以通过观察现象认识物质变化的情况.请分析以下一组有现象变化的化学反应.
实验 | 试剂及操作 | 现象 | |
试管 | 滴管 | ||
| 饱和Na2SlO3溶液(含2滴酚酞) | 先滴加1.0mL0.5molL﹣1NaOH溶液:再滴加1.5mL1.0molL﹣1H2SO4溶液 | Ⅰ.红色溶液中出现胶状沉淀 |
0.1molL﹣1AlCl3溶液 | Ⅱ.加碱时 ;加酸时产生白色沉淀,又逐渐溶解直至消失 | ||
0.1molL﹣1Fe(NO3)2溶液 | Ⅲ.加碱时 ;加酸后溶液变为黄色 | ||
新制饱和氯水 | Ⅳ.加碱时溶液变为无色;加酸后无色溶液变为浅黄绿色 | ||
(1)用离子方程式解释现象I中出现胶状沉淀的原因: .
(2)II中加碱时出现的现象是 , 此现象说明溶液中发生反应的离子方程式是 .
(3)III中加碱时出现的现象是 .
(4)用离子方程式解释IV中加碱时出现的现象 .
(5)滴加试剂顺序的变化,会影响溶液中的现象和发生的反应,请继续分析以下实验.
实验 | 试剂及操作 | 现象 | |
试管 | 滴管 | ||
| 0.1 molL﹣1 Fe(NO3)2溶液 | 先滴加1.5 mL 1.0 molL﹣1 H2SO4溶液; | V.加酸时溶液无明显现象;加碱后溶液依然没有明显变化 |
①探究加酸时Fe(NO3)2溶液中是否发生了反应:
向1.0mL 0.1molL﹣1Fe(NO3)2溶液中 , 溶液立即变红,说明溶液中含Fe3+ , 证明加酸时溶液中发生了反应.
②推测溶液中产生Fe3+的可能原因有两种:
a.酸性条件下,0.1molL﹣1 Fe(NO3)2溶液中的Fe2+被NO3﹣氧化;
b.(用离子方程式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示物质结构的化学用语或说法中,正确的是( )
A.中子数为8的氮原子:8N
B.次氯酸的电子式: ![]()
C.PCl5分子的每个原子都满足8电子稳定结构
D.用电子式表示NaCl的形成过程: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图装置完成下表所列的四个实验,不能达到实验目的是( )
选项 | 实验目的 | 试剂X | 试剂Y |
A | 验证C2H5OH与浓H2SO4加热至170℃制得的乙烯的性质 | NaOH溶液 | Br2水 |
B | 检验FeSO4受热分解产生的气体中由SO3和SO2 | BaCl2溶液 | 品红溶液 |
C | 验证电石与饱和食盐水反应生成的乙炔的性质 | CuSO4溶液 | KMnO4溶液 |
D | 验证氧化性:Cl2>Br2>I2 | NaBr溶液 | KI溶液 |
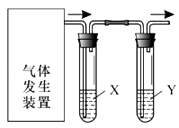
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提纯下列物质(括号内的物质为杂质),所选用的除杂试剂和分离方法都正确的是( )
选项 | A | B | C | D |
被提纯物质 | 乙醇(水) | 乙醇(乙酸) | 乙烷(乙烯) | 溴苯(溴) |
除杂试剂 | 生石灰 | 氢氧化 钠溶液 | 酸性高锰 酸钾溶液 | KI溶液 |
分离方法 | 蒸馏 | 分液 | 洗气 | 分液 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com