
下列有关电化学装置完全正确的是( )
| A | B | C | D |
|
|
|
|
|
| 铜的冶炼 | 铁上镀银 | 防止Fe被腐蚀 | 构成铜锌原电池 |
|
| A. | A | B. | B | C. | C | D. | D |
| 原电池和电解池的工作原理. . | |
| 专题: | 电化学专题. |
| 分析: | A、铜的冶炼,粗铜的精炼中粗铜作阳极; B、铁片镀银,铁片应作阴极; C、电解池中阴极被保护; D、含有盐桥的原电池中,同一半反应装置中电极材料和电解质溶液中的金属阳离子是相同的元素; |
| 解答: | 解:A、与电源负极相连的为阴极,粗铜的精炼中粗铜作阳极,由图可知,粗铜作阴极,故A错误; B、铁片镀银,铁片应作阴极,银座阳极,硝酸银做电解质溶液,图中铁做阳极,故B错误; C、铁做电解池的阴极,被保护,故C正确; D、该装置中,同一半反应装置中电极材料和电解质溶液中的金属阳离子不是相同的元素,故D错误; 故选C. |
| 点评: | 本题考查原电池与电解原理的应用,明确正负极与阴阳极的判断及发生的电极反应是解答本题的关键,注意电解池中如果较活泼的金属作阳极,电解池工作时,阳极上金属失电子而不是溶液中阴离子失电子,难度不大. |


科目:高中化学 来源: 题型:
I、煤炭中以FeS2形式存在的硫,在有水和空气及在脱硫微生物存在下发生生物氧化还原反应,有关反应的离子方程式依次为:
①2FeS2+7O2+2H2O 4H++2Fe2++4SO42- ;
4H++2Fe2++4SO42- ;
②Fe2++O2+H+ Fe3++____________;
Fe3++____________;
③FeS2+2Fe3+ 3Fe2++2S;
3Fe2++2S;
④2S+3O2+2H2O 4H++2SO42-。
4H++2SO42-。
已知:FeS2中的硫元素为-1价。
回答下列问题:
(1)根据质量守恒定律和电荷守恒定律,将上述②离子方程式配平并补充完整
(2)反应③的还原剂是__________________。
(3)观察上述反应,硫元素最终转化为____________从煤炭中分离出来
II、在淀粉KI溶液中,滴入少量NaClO溶液,溶液立即变蓝,有关反应的离子方程式是_____________________________ 。 在上述蓝色溶液中,继续滴加足量的NaClO溶液,蓝色逐渐消失,有关反应的离子方程式是_______________________ _。(提示:碘元素被氧化成IO3—)从以上实验可知,ClO—、I2、IO3—的氧化性由强到弱的顺序是 。
III、工业上用黄铜矿(CuFeS2)冶炼铜,副产品中也有SO2 ,冶炼铜的反应为
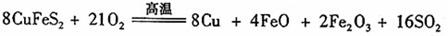
若CuFeS2中 Fe 的化合价为+2 ,反应中被还原的元素是 (填元素符号)。当生成0.8 mol铜时,此反应转移的电子数目是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.糖类、油脂、蛋白质都能发生水解反应 B.糖类、油脂、蛋白质都是由C、H、O三种元素组成的
C.糖类、油脂、蛋白质都是高分子化合物 D.油脂有油和脂肪之分,但都属于酯
查看答案和解析>>
科目:高中化学 来源: 题型:
镍镉(Ni﹣Cd)可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2,下列说法不正确的是( )
Cd(OH)2+2Ni(OH)2,下列说法不正确的是( )
|
| A. | 放电时化学能不能全部转化为电能 |
|
| B. | 放电时Cd为该电池的负极,充电时这一端应接直流电源的正极 |
|
| C. | 放电时该电池的正极反应为:NiOOH+H2O+e﹣═Ni(OH)2+OH﹣ |
|
| D. | 充电时,阴极反应为:Cd(OH)2+2e﹣═Cd+2OH﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽,用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液.下列说法正确的是( )
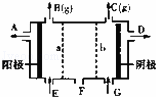
|
| A. | 从A口出来的是H2SO4溶液 | B. | 阳极反应式为2H++2e﹣═H2↑ |
|
| C. | a是阳离子交换膜,允许H+通过 | D. | Na2SO4溶液从E口加入 |
查看答案和解析>>
科目:高中化学 来源: 题型:
设阿伏伽德罗常数为NA,下列说法正确的是
A.pH = 1 的H2SO4溶液中所含H+的个数为0.1NA
B.100mL 0.1mol·L-1的NH4Cl溶液所含NH4+的个数为0.01 NA
C.电解精炼铜的过程中,外电路转移NA个电子,阴极生成铜的质量为32g
D.将2molSO2和10molO2充入一密闭容器中完全反应后,生成SO3的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W、R五种分属于不同主族的短周期元素,原子序数依次增大,X是空气中含量最多的元素;Y、Z、W的最高价氧化物的水化物可以两两相互反应。
(1) R在周期表中的位置________;Z的原子结构示意图为_________。
(2) W原子的核外电子排布式是 ,在Z、W、R三原子中,未成对电子数最少的是 (填元素符号)
(3) W的氢化物A的分子构型为_____ __; 与W同主族且半径比W小的元素所形成的氢化物B,A的沸点比B的沸点 (填“高”或“低”),原因是
__; 与W同主族且半径比W小的元素所形成的氢化物B,A的沸点比B的沸点 (填“高”或“低”),原因是
(4) X的氢化物与其最高价氧化物的水化物等物质的量反应后,所生成的溶液中各离子浓度从大到小的顺序是
(5)Y、Z能够形成合金,且该合金中Y、Z的质量比为23:27,如果将含l mol Y的该合金置于足量水中充分反应,放出标况下气体________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
由硫可得多硫化钠Na2Sx,x值一般为2~6,已知Na2Sx与NaClO反应的化学方程式如下:
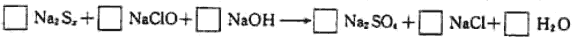 试配平上述方程式,若某多硫化钠在反应中消耗的NaClO和NaOH的物质的量之比为2:1,试以求得的x值写出该多硫化钠的分子式_________。
试配平上述方程式,若某多硫化钠在反应中消耗的NaClO和NaOH的物质的量之比为2:1,试以求得的x值写出该多硫化钠的分子式_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com