
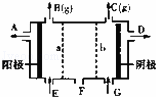
现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽,用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液.下列说法正确的是( )
|
| A. | 从A口出来的是H2SO4溶液 | B. | 阳极反应式为2H++2e﹣═H2↑ |
|
| C. | a是阳离子交换膜,允许H+通过 | D. | Na2SO4溶液从E口加入 |
| 原电池和电解池的工作原理. . | |
| 专题: | 电化学专题. |
| 分析: | 据题意,电解饱和Na2SO4溶液时,阳极附近是OH﹣放电,生成氧气,阴极附近时H+放电生成氢气,由于装置中放置了离子交换膜,在两极分别生成NaOH和H2SO4,需在阳极室一侧放置阴离子交换膜,只允许通过阴离子,在阴极一侧放置阳离子交换膜,只允许通过阳离子;接电源正极的是阳极,即A极放出氧气. |
| 解答: | 解:A、连接电源正极的是电解池的阳极,连接电源负极的是电解池的阴极,A为阳极是氢氧根离子放电产生的气体是氧气,同时生成氢离子,则阳极附近生成硫酸,则从A口出来的是H2SO4溶液,故A正确; B、阳极是氢氧根离子放电,阳极发生的反应为:2H2O﹣4e﹣═O2↑+4H+,故B错误; C、在阳极室一侧放置阴离子交换膜,只允许通过阴离子,故C错误; D、NaOH在阴极附近生成,则Na2SO4溶液从G口加入,故D错误. 故选A. |
| 点评: | 本题考查电解池知识,本题设置新情景,即离子交换膜,注意根据两极上的反应判断生成物,题目难度中等. |


科目:高中化学 来源: 题型:
X、Y、Z是位于不同周期的三种短周期元素,且原子序数逐渐增大,X、Z属于同一主族,三种元素可以形成原子个数比为1:1:1的化合物W。下列推测正确的是
A.元素Z的氧化物一定属于碱性氧化物
B.原子半径关系是:X<Y<Z
C.三种元素中,Y的金属性最强
D.Y、Z都能形成含氧酸,且前者的酸性比后者酸性强
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是 ( )



|


|
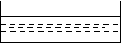 C、a为正极,是碳棒,烧杯中的溶液为硫酸
C、a为正极,是碳棒,烧杯中的溶液为硫酸
D、b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
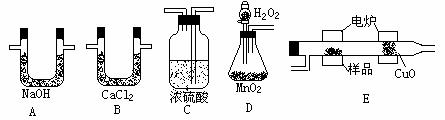 化学上常用燃烧法确定有机物的组成。这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成。下列装置是用燃烧法确定有机物分子式常用的装置。回答下列问题:
化学上常用燃烧法确定有机物的组成。这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成。下列装置是用燃烧法确定有机物分子式常用的装置。回答下列问题:
(1)产生的氧气按从左到右流向,所选装置的连接顺序为
(2)C装置中浓硫酸的作用是 ;
(3)D装置中MnO2的作用是 ;
(4)燃烧管中CuO的作用是 ;
(5)若准确称取0.90g样品(只含C、H、O三种元素中的两种或三种)经充分燃烧后,A管质量增加1.32g,B管质量增加0.54g,则该有机物的最简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
控制适当的条件,将反应Fe3++Ag═Fe2++Ag+设计成如图所示的原电池.下列判断正确的是( )
|
| A. | 反应开始时,石墨棒作阳极,银棒作阴极 |
|
| B. | 灵敏电流计的读数由小变大,再变小 |
|
| C. | 反应达化学平衡时,电流计读数最大 |
|
| D. | 反应达化学平衡时,在乙烧杯中滴入一定量的NaCl溶液,电流计指针又偏转 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.除去Cu2+中的少量Fe3+,可加入CuO
B.沸点:晶体硅 > SiO2 > SiCl4 > NaCl
C.Cu(NH3)42+中的配位键是由Cu2+提供孤对电子,NH3提供空轨道形成的
D.石油的分馏、煤的液化以及煤的干馏等生产过程中均只发生物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
往含0.2mol NaOH和0.1mol Ca(OH)2的溶液中持续稳定地通入CO2气体,当通入气体为6.72L(S.T.P)时立即停止,则这一过程中,溶液中离子的物质的量和通入CO2气体的体积关系正确的图象是(气体的溶解忽略不计)( )
|
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,能氧化浓盐酸生成C12;
(1)写出Pb3O4与浓盐酸反应的化学方程式 。
(2)PbO2不稳定,随温度升高按下列顺序逐步分解:PbO2→Pb2O3→Pb3O4→PbO。若加
热分解后所得到的固体全部为Pb3O4,现将a mol PbO2加热分解,则加热过程中放出O2__________L(标准状况下);
(3)现将1 mol PbO2加热分解,收集产生的O2,加热分解后所得固体中,pb2+占Pb元
素的物质的量分数为x;再向加热所得固体中加入足量的浓盐酸,收集产生的C12,收集
到O2和C12的物质的量之和为y mol。
试回答下列问题:
①通过计算确定y与x的函数关系式。
②若两步反应中O2和Cl2的物质的量之比为3:5,则剩余固体中含有的物质为 ,其物质的量之比为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com