
I、煤炭中以FeS2形式存在的硫,在有水和空气及在脱硫微生物存在下发生生物氧化还原反应,有关反应的离子方程式依次为:
①2FeS2+7O2+2H2O 4H++2Fe2++4SO42- ;
4H++2Fe2++4SO42- ;
②Fe2++O2+H+ Fe3++____________;
Fe3++____________;
③FeS2+2Fe3+ 3Fe2++2S;
3Fe2++2S;
④2S+3O2+2H2O 4H++2SO42-。
4H++2SO42-。
已知:FeS2中的硫元素为-1价。
回答下列问题:
(1)根据质量守恒定律和电荷守恒定律,将上述②离子方程式配平并补充完整
(2)反应③的还原剂是__________________。
(3)观察上述反应,硫元素最终转化为____________从煤炭中分离出来
II、在淀粉KI溶液中,滴入少量NaClO溶液,溶液立即变蓝,有关反应的离子方程式是_____________________________ 。 在上述蓝色溶液中,继续滴加足量的NaClO溶液,蓝色逐渐消失,有关反应的离子方程式是_______________________ _。(提示:碘元素被氧化成IO3—)从以上实验可知,ClO—、I2、IO3—的氧化性由强到弱的顺序是 。
III、工业上用黄铜矿(CuFeS2)冶炼铜,副产品中也有SO2 ,冶炼铜的反应为
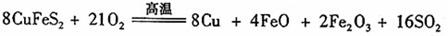
若CuFeS2中 Fe 的化合价为+2 ,反应中被还原的元素是 (填元素符号)。当生成0.8 mol铜时,此反应转移的电子数目是___________________。
科目:高中化学 来源: 题型:
四氯化钛是无色液体,沸点为136℃。它极易水解,遇空气中水蒸气即产生“白烟”(TiCl4+H2O=TiOCl2+2HCl↑),在650℃~850℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和一种有毒气体。下图是实验室制备TiCl4的反应装置,其主要操作步骤如下:
①连接好整套装置,在通Cl2前先通入CO2气体并持续一段时间;
②当锥形瓶中TiCl4的量不再增加时,停止加热,从侧管中改通CO2气体直到电炉中的瓷管冷却为止;
③将TiO2、炭粉混合均匀后,装入管式电炉中;
④ 将电炉升温到800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水。
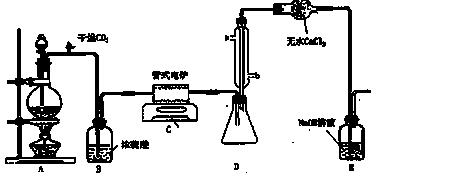
试回答下列问题:
(1)正确的操作顺序为(填序号) 。
(2)装置A中的反应的离子方程式为
。
(3)C装置中的反应方程式为: 。
(4)操作①的目的是
。
(5)装置D中冷凝管进水口的位置是(填a或b) ,装置E的作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式与所述事实相符且正确的是( )
A.氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
B.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-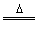 Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
C.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
D.Fe3O4与稀HNO3反应:Fe3O4+8H+ =Fe2++2Fe3++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,正确的是
A.用丁达尔现象实验可以区分食盐水和淀粉溶液
B.氨气的水溶液能导电,所以氨气是电解质
C.NO2、SO2溶于水都发生氧化还原反应
D.Fe分别与氯气和稀盐酸反应可得到同一种氯化物
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z是位于不同周期的三种短周期元素,且原子序数逐渐增大,X、Z属于同一主族,三种元素可以形成原子个数比为1:1:1的化合物W。下列推测正确的是
A.元素Z的氧化物一定属于碱性氧化物
B.原子半径关系是:X<Y<Z
C.三种元素中,Y的金属性最强
D.Y、Z都能形成含氧酸,且前者的酸性比后者酸性强
查看答案和解析>>
科目:高中化学 来源: 题型:
用下列实验装置进行相应实验,能达到实验目的是( )
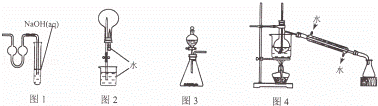
|
| A. | 用图1装置作为制取二氧化碳的尾气吸收装置 |
|
| B. | 用图2装置进行二氧化碳喷泉实验 |
|
| C. | 用图3装置进行二氧化锰和浓盐酸制取氯气的实验 |
|
| D. | 用图4装置进行石油的分馏实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是( )
①质子数相同的微粒一定属于同一种元素 ②同位素的性质几乎相同
③质子数相同,电子数也相同的两种微粒,不可能是一种分子和一种离子
④电子数相同的微粒不一定是同一种元素
⑤某元素一种同位素原子的质子数为m,中子数为n,不能由此确定该元素的相对原子质量
A.②③ B.①②④ C.①② D.③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com