
【题目】某兴趣小组对NH4NO3的热分解产物提出如下4种猜想:
甲:N2、HNO3、H2O 乙:N2O、NO、H2O
丙:NH3、N2、H2O 丁:N2、NO、H2O
你认为猜想有科学性不正确的是( )
A.甲和乙B.乙和丁C.乙和丙D.丙和丁
 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】如图是硫酸试剂瓶标签上的内容:

(1)某化学兴趣小组进行硫酸性质的实验探究时,需要490mL0.92mol·L-1的稀硫酸,现要配制该浓度的溶液所需的玻璃仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要__(填仪器名称);需要量取98%浓硫酸__mL进行配制;
(2)配制溶液时有如下操作:a.稀释溶解b.摇匀c.洗涤d.冷却e.量取f.将溶液移至容量瓶g.定容,实验操作顺序正确的是(_____)
A.e→a→f→d→c→f→g→b B.e→a→d→f→c→f→g→b
C.e→a→f→d→c→f→b→g D.e→a→d→f→c→f→b→g
(3)在配制0.92mol·L-1稀硫酸的过程中,下列情况会引起配制所得的硫酸溶液物质的量浓度偏低的是__;
A.未经冷却趁热将溶液注入容量瓶中 B.量取浓硫酸时仰视读数
C.定容时俯视观察液面 D.未洗涤烧杯和玻璃棒
(4)为中和100mL2.3mol·L-1KOH溶液使其恰好完全反应,需要加入__mL0.92mol·L-1稀硫酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有效去除废水中的H2SiF6、F-,改善水质是环境部门的重要研究课题。
(1)AlF3是有机合成中常用催化剂,利用废水中的H2SiF6可转变制得,相关的热化学方程式如下:
3H2SiF6(aq)+2Al(OH)3(s)=Al2(SiF6)3(aq)+6H2O(l);ΔH=akJ·mol-1
Al2(SiF6)3(aq)+6H2O(l)=2AlF3(aq)+3SiO2(s)+12HF(aq);ΔH=bkJ·mol-1
3HF(aq)+Al(OH)3(s)=AlF3(aq)+3H2O(l);ΔH=ckJ·mol-1
则反应H2SiF6(aq)+2Al(OH)3(s)=2AlF3(aq)+SiO2(s)+4H2O(l)的ΔH=__kJ·mol-1。
(2)废水的酸碱度及废水中的Fe3+对F-浓度的测定都会产生一定的影响。
①测定时,通常控制废水的pH在5~6之间。pH过小所测F-浓度偏低,其原因是__。
②Fe3+与柠檬酸根(C6F5O73-)、F-反应可表示为Fe3++nC6H5O73-![]() Fe(C6H5O7)n(3n-3)-、Fe3++nF-
Fe(C6H5O7)n(3n-3)-、Fe3++nF-![]() FeFn(3-n)。向含有Fe3+的含氟废水中加入柠檬酸钠(C6H5O7Na3)可消除Fe3+对F-测定的干扰,其原因是__。
FeFn(3-n)。向含有Fe3+的含氟废水中加入柠檬酸钠(C6H5O7Na3)可消除Fe3+对F-测定的干扰,其原因是__。
(3)利用聚苯胺可吸附去除水中F-。用惰性电极电解苯胺(![]() )和盐酸的混合液可在阳极获得聚苯胺薄膜,变化过程如图:
)和盐酸的混合液可在阳极获得聚苯胺薄膜,变化过程如图:
![]()
写出阳极生成二聚体的电极反应方程式:___。
(4)利用MgCO3、Ca(OH)2和CaCO3等可沉淀去除废水中F-。
①以MgCl2溶液、尿素[CO(NH2)2]为原料可制得MgCO3,写出该反应的化学方程式:__。
②取三份相同的含F-的酸性废水,分别加入足量的MgCO3、Ca(OH)2和CaCO3。相同时间后溶液的pH及F-残留量如图1所示。实际废水处理过程中常选用MgCO3的理由是:__。
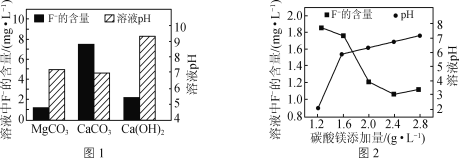
③改变碳酸镁添加量,处理后废水中F-含量及溶液pH的变化如图2所示。添加量超过2.4g·L-1后,F-含量略有升高的原因是___。{Ksp(MgF2)=7.4×10-11,Ksp[Mg(OH)2]=5.6×10-12}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些难溶性铅盐可用作涂料,如秦俑彩绘中使用的铅白(PbCO3)和黄金雨中黄色的PbI2。室温下,PbCO3 和 PbI2 在不同的溶液中分别达到溶解平衡时-lgc(Pb2+)与-lgc(CO32-)或-lgc(I-)的关系如图所示。下列说法错误的是
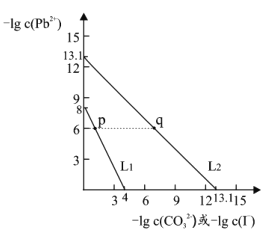
A.Ksp(PbCO3)的数量级为 10-14
B.相同条件下,水的电离程度 p 点大于 q 点
C.L1 对应的是-lgc(Pb2+)与-lgc(I-)的关系变化
D.p 点溶液中加入 Na2CO3 浓溶液,可得白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把盛有几小块镁片的试管放入盛有25℃的饱和石灰水的烧杯中,再用滴管向试管中滴入2 mL的稀盐酸。下列对烧杯中的实验现象的描述及原因说明正确的是( )
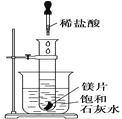
A. 烧杯中出现白色浑浊,原因是试管中的反应放出热量使烧杯中饱和石灰水温度升高,溶质析出
B. 烧杯中出现白色浑浊,原因是试管中的反应吸收热量使烧杯中饱和石灰水温度降低,溶质析出
C. 烧杯中没有任何现象,原因是试管中的反应对烧杯中饱和石灰水不会产生任何影响
D. 烧杯中没有任何现象,原因是试管中的反应既不放出热量,也不吸收热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的两种金属粉末A、B分别与同浓度的足量稀盐酸反应,都生成+2价金属氯化物,其反应情况如图所示:
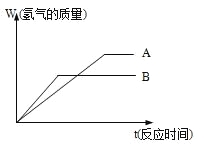
(1) 两种金属的活动性顺序是_____>______
两种金属氯化物的摩尔质量是_____>______
(2) 将两种金属粉末按一定比例混合后,进行甲、乙
丙三组实验,三组实验各取500mL同浓度的盐酸
溶液加入该种混合粉末,产生气体,有关数据如下:
实验序号 | 甲 | 乙 | 丙 |
混合粉末质量(g) | 6.2 | 18.6 | 24.8 |
生成气体气体(mL) | 2240 | 5600 | 5600 |
①乙组实验中,盐酸________(填“过量”、“适量”或“不足量”)
②上述所用的盐酸的物质的量浓度为_____mol/L,混合粉末的平均摩尔质量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在某2 L恒容密闭容器中加入纳米级氧化亚铜并通入0.1 mol 水(g),发生如下反应:2H2O(g)![]() 2H2(g)+O2(g) ΔH=+484 kJ·mol-1。不同时间产生O2的物质的量见下表:
2H2(g)+O2(g) ΔH=+484 kJ·mol-1。不同时间产生O2的物质的量见下表:

下列说法不正确的是( )
A. 前20 min内的平均反应速率v(H2O)=5×10-5mol·L-1·min-1
B. 达到平衡时,需要从外界吸收的能量为0.968 kJ
C. 增大水的浓度,可以改变待反应的限度
D. 使用纳米级的氧化亚铜,可以增大平衡时氧气的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过测定反应过程中所放出的热量可计算中和热。50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在图示的装置中进行中和反应.回答下列问题:
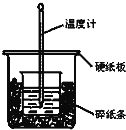
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是___________.
(2)大烧杯上如果不盖硬纸板,求得的中和热数值__________(填“偏大”,“偏小”或“无影响”).
(3)实验中改用60mL 0.50mol/L盐酸跟50mL 0.55mol/LNaOH溶液进行反应,与上述实验相比,所求中和热________(填“相等”“不相等”),简述理由:______________________.
(4)若两溶液的密度都是1g/mL,中和后所得溶液的比热容c=4.18J/(g·℃),三次平行操作测得终止温度与起始温度差(t2﹣t1)分别为:①3.2℃ ②2.2℃ ③3.0℃,写出表示盐酸与NaOH溶液反应的中和热的热化学方程式________________________.(小数点后保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
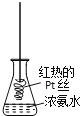
【题目】探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是( )
A. 将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水
B. 将pH=11的氨水稀释1000倍,测得pH>8,说明NH3·H2O为弱碱
C. 加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3受热不稳定
D. 将红热的Pt丝伸入右图所示的锥形瓶中,瓶口出现少量红棕色气体,说明氨气的氧化产物为NO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com