
【题目】一定温度下,在某2 L恒容密闭容器中加入纳米级氧化亚铜并通入0.1 mol 水(g),发生如下反应:2H2O(g)![]() 2H2(g)+O2(g) ΔH=+484 kJ·mol-1。不同时间产生O2的物质的量见下表:
2H2(g)+O2(g) ΔH=+484 kJ·mol-1。不同时间产生O2的物质的量见下表:

下列说法不正确的是( )
A. 前20 min内的平均反应速率v(H2O)=5×10-5mol·L-1·min-1
B. 达到平衡时,需要从外界吸收的能量为0.968 kJ
C. 增大水的浓度,可以改变待反应的限度
D. 使用纳米级的氧化亚铜,可以增大平衡时氧气的体积分数
【答案】D
【解析】
A. 前20 min内,生成0.0010mol氧气,则消耗0.0020mol水蒸气,水蒸气的浓度变化量为0.0020mol/2L=0.0010mol·L-1,所以v(H2O)=0.0010mol·L-1/20min=5×10-5mol·L-1·min-1,故A不选;
B. 达到平衡时,生成0.0020mol氧气,根据热化学方程式,生成1mol氧气,需要吸收484 kJ的热量,所以生成0.0020mol氧气,需要从外界吸收的能量为484 kJ ×0.0020mol=0.968 kJ,故B不选;
C. 增大水蒸气的浓度,可以使平衡右移,故C不选;
D.氧化亚铜是催化剂,只能加快反应速率,不能使平衡发生移动,所以不能改变平衡时氧气的体积分数,故D选。
故选D。


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案科目:高中化学 来源: 题型:
【题目】火力发电厂释放的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染和温室效应。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现节能减排、废物利用等目的。
(1)脱硝:利用CH4催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=1160kJ·mol-1
CH4直接将NO2还原为N2的热化学方程为___。
(2)脱碳:将CO2转化为甲醇(CH3OH)的热化学方程式如下:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g);ΔH3
CH3OH(g)+H2O(g);ΔH3
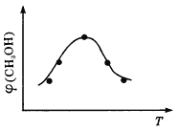
①取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图所示,则上述反应的ΔH3____0(填“>”“<”或“=”);
②在一个恒温恒容密闭容器中充入1molCO2和3molH2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
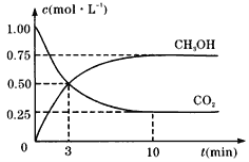
试回答:
0~10min内,CO2的平均反应速率为___mol·L1·min1;该温度下,反应的平衡常数的值为___(结果保留一位小数);第10min后,若向该容器中再充入1molCO2和3molH2,则再次达到平衡时CH3OH(g)的体积分数____(填“增大”、“减小”或“不变”)。
(3)脱硫:①某种脱硫工艺将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。设参与反应的SO2、NO2的物质的量之比为1∶1,则该反应的化学方程式为___。
②硫酸铵和硝酸铵的水溶液pH<7,其原因用离子方程式表示为___。在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中:c(Na+)+c(H+)___c(NO3)+c(OH)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用系统命名法命名或写出结构简式:
(1)3-甲基-2-丙基-1-戊烯的结构简式为______
(2)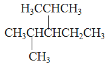 的名称为________
的名称为________
(3)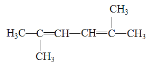 的名称为________
的名称为________
(4)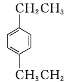 的名称为_______
的名称为_______
(5)![]() 的名称为________
的名称为________
(6)![]() 的名称为________
的名称为________
(7)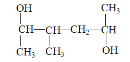 的名称为_______
的名称为_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组对NH4NO3的热分解产物提出如下4种猜想:
甲:N2、HNO3、H2O 乙:N2O、NO、H2O
丙:NH3、N2、H2O 丁:N2、NO、H2O
你认为猜想有科学性不正确的是( )
A.甲和乙B.乙和丁C.乙和丙D.丙和丁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烷烃脱氢制烯烃是化工领域研究的热点过程。在 Pt-Sn/Zn/Al2O3 催化作用下丙烷脱氢过程主要反应有:
反应 i:C3H8 (g)C3H6 (g) + H2 (g) △H1= +125 kJ·mol -1
反应 ii:C3H8 (g)+ H2 (g)C2H6(g) + CH4 (g) △H2= -56 kJ·mol -1
......
回答下列问题:
(1)丙烷脱氢过程中,生成的气体产物除 C3H6、C2H6、CH4、H2 外,还可能有_____。
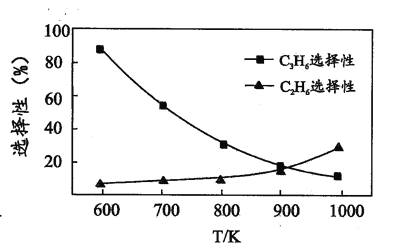
(2)丙烷脱氢反应 i、ii 的选择性和温度的关系如图所示。1000 K 时丙烷更容易断裂的化学键为_____。
(3)在 883 K,102 kPa 条件下发生反应 i,其反应速率v正=k正 P(C3H8), v逆=k逆 P2(C3H6),该温度下速率常数 k正和 k逆数值分别为 6.0 min-1、1.3×10-3kPa-1·min-1,计算平衡常数 Kp =_____(保留 1 位小数)。当丙烷与丙烯的物质的量分数相等时,V正=_____kPa·min-1,此时反应向_____(填“向正反应进行”、“向逆反应进行”或“达到平衡状态”)。
(4)为研究丙烷脱氢转化率的影响因素,科学家在不同反应器中分别通入一定量的 CO2 或水蒸气进行试验:
①恒容条件下,通入 CO2 增加了反应 CO2 (g)+ H2 (g)CO(g) + H2O(g) △H3<0。通入CO2 能提高丙烷脱氢转化率的原因是_____。
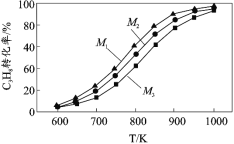
②恒压条件下,按不同水烃比 M=n(H2O)/n(C3H8)进行实验,丙烷的平衡转化率和温度、水烃比的关系如图所示。则 M1、M2、M3 由大到小的顺序为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用湿法工艺从阳极泥(主要含有Cu、Ag、Au)中提取Ag、Au的流程如图所示:
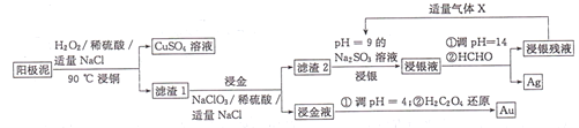
回答下列问题:
(1)“浸铜”时,铜参与反应的离子方程式为______________;若温度过高,铜的浸出率会降低,原因是______________。
(2)“浸金液”的主要成分是H[AuCl4],则“浸金”步骤发生反应的化学方程式为NaCl+NaClO3+Au+H2SO4→Na2SO4+H2O+H[AuCl4](未配平),该反应中氧化剂与还原剂物质的量之比为______________,“王水”也可溶解金,王水的成分为______________。
(3)从“浸金液”中提取金时氧化剂和还原剂的物质的量之比为______________。
(4)“浸银”时发生反应AgCl+2SO32-![]() Ag(SO3)23-+C1-,Ag(SO3)23-将HCHO氧化为CO32-。向“浸银残液”中通入气体X,可得到Na2SO3再生液,X的化学式为______________,Na2SO3再生液的循环使用次数与银的浸出率关系如图所示:
Ag(SO3)23-+C1-,Ag(SO3)23-将HCHO氧化为CO32-。向“浸银残液”中通入气体X,可得到Na2SO3再生液,X的化学式为______________,Na2SO3再生液的循环使用次数与银的浸出率关系如图所示:

从平衡移动角度解释上述曲线的变化原因:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业所需氢气大部分由化学法制得,制取出过程中不可避免的会产生副产物CO、CO2、H2S等,CO选择性催化甲烷化技术可实现CO转化为CH4和H2O以达到净化氢气的目的。富氢气氛中CO和CO2甲烷化反应:
CO(g)+3H2(g)![]() CH4(g)+H2O(g)△H=-206.2kJmol-1
CH4(g)+H2O(g)△H=-206.2kJmol-1
CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)△H=-165.0kJmol-1
CH4(g)+2H2O(g)△H=-165.0kJmol-1
回答下列问题:
(1)CO的转化率(![]() )及H2对CO的选择性(
)及H2对CO的选择性(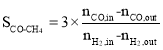 )是衡量工艺优劣的重要指标。其中nco,in及
)是衡量工艺优劣的重要指标。其中nco,in及![]() 分别为反应器入口CO、H2物质的量;nco,out及
分别为反应器入口CO、H2物质的量;nco,out及![]() 分别为反应器出口CO、H2的物质的量。
分别为反应器出口CO、H2的物质的量。
①以一定流速将富氢(含CO和CO2通过反应器 ,温度低于250℃时,在Ni-ZrO2-SiO2催化剂表面CO和CO2甲烷化速率均随温度升高而增大,则该温度范围内XCO将________(填“增大”“减小”或“无法判断”)。
②温度高于270℃反应CO2速率迅速增加,此时H2对CO的选择性开始________(填“升高”“下降”或“不变”)。
(2)恒温恒容条件下H2S发生分解反应,2H2S(g)![]() 2H2(g)+S2(g),初始投入2molH2S和1moH2,容器中的压强为p,一段时间后反应达到平衡,H2S的物质的量为1mol。
2H2(g)+S2(g),初始投入2molH2S和1moH2,容器中的压强为p,一段时间后反应达到平衡,H2S的物质的量为1mol。
①则初始时H2S的分压为________ 。
②该反应的Kp=________(Kp表示分压平衡常数,分压=总压×物质的量分数)。
(3)甲烷化过程中H2S会使催化剂中毒,下是图3个H2S在催化剂表面逐步解离的能量变化图:
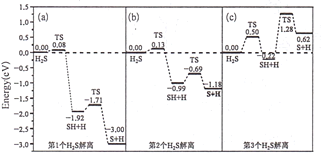
注:TS表示过渡状态
①(c)图中H2S的解离分为________步,决定分解速率快慢的是第________步.
②(b)图SH解离为硫原子和氢原子的反应热为________eV.
③Prodhomme研究发现H2S的解离难易与硫原子在催化剂表面吸附的多少有一定关系,观察上图预测该关系为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼金属铝。下列说法错误的是( )
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
A. ①中还需要进行过滤操作,滤渣为二氧化硅
B. a、b中铝元素的存在形式不同
C. ③中需要通入过量的氨气
D. ④进行的操作是加热,而且d一定是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矿(主要成分FeS2)、黄铜矿(主要成分CuFeS2)均是自然界中的常见矿物资源。
(1)Stumm和Morgan提出黄铁矿在空气中氧化的四步反应如题20图-1所示:
① a反应中每生成1molFeSO4转移电子的物质的量为___mol。
② d反应的离子方程式为_______________。
(2)用细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高浸取速率,其原理如题20图-2
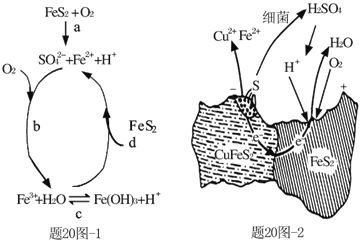
①冶炼过程中,正极周围溶液的pH___(选填:“增大”、“减小”或“不变”)
②负极产生单质硫的电极反应式为___。
这里,否则就错了!!阅后删除! |
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见下表),其相关反应的平衡常数的对数值与温度的关系如题20图-3。
相关反应 | 反应热 | 平衡常数K |
FeS2(s) + H2(g) | ΔH1 | K1 |
1/2 FeS2(s) + H2(g) | ΔH2 | K2 |
FeS(s) + H2(g) | ΔH3 | K3 |
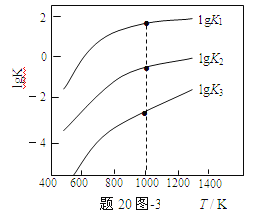
①上述反应中,ΔH1___0(选填:“>”或“<”)。
②提高硫的脱除率可采取的措施有___(举1例)。
③1000K时,平衡常数的对数lgK1、lgK2和lgK3之间的关系为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com