
【题目】用系统命名法命名或写出结构简式:
(1)3-甲基-2-丙基-1-戊烯的结构简式为______
(2)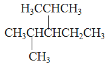 的名称为________
的名称为________
(3)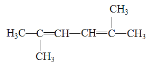 的名称为________
的名称为________
(4)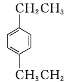 的名称为_______
的名称为_______
(5)![]() 的名称为________
的名称为________
(6)![]() 的名称为________
的名称为________
(7)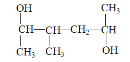 的名称为_______
的名称为_______
【答案】![]() 2,4-二甲基-3-乙基戊烷 2,5-二甲基-2,4-己二烯 1,4-二乙苯 2-甲基丁烷 3-甲基-1-丁炔 3-甲基-2,5-己二醇
2,4-二甲基-3-乙基戊烷 2,5-二甲基-2,4-己二烯 1,4-二乙苯 2-甲基丁烷 3-甲基-1-丁炔 3-甲基-2,5-己二醇
【解析】
(1)最长的碳链有5个碳,其中3号碳上有甲基,2号碳上有丙基,1号碳上有双键,结构简式为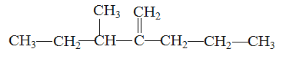 ;
;
答案为: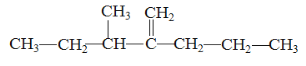 ;
;
(2)最长的碳链为5个碳,2号和4号碳上分别有一个甲基,3号碳上有一个乙基;
名称为2,4-二甲基-3-乙基戊烷;
答案为:2,4-二甲基-3-乙基戊烷;
(3)含双建的最长的碳链为6个碳,2号和5号碳上分别有一个甲基,2号和4号碳上分别有一个双键;名称为2,5-二甲基-2,4-己二烯;
答案为:2,5-二甲基-2,4-己二烯;
(4)分子结构中有苯环,1号碳和4号碳分别有一个乙基,名称为1,4-二乙苯;
答案为:1,4-二乙苯;
(5)最长的碳链为4个碳,2号碳上有一个甲基,名称为2-甲基丁烷;
答案为:2-甲基丁烷;
(6)含三键的最长的碳链为4个碳,3号碳上有一个甲基,1号碳上有个三键,名称为3-甲基-1-丁炔;
答案为:3-甲基-1-丁炔;
(7)含羟基的最长的碳链有6个碳,3号碳上有一个甲基,2号碳和5号碳分别有一个羟基,名称为3-甲基-2,5-己二醇;
答案为:3-甲基-2,5-己二醇;


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案科目:高中化学 来源: 题型:
【题目】已知A是一种常见的一种金属,F是一种红褐色的沉淀。试根据图中转化关系,回答下列问题。
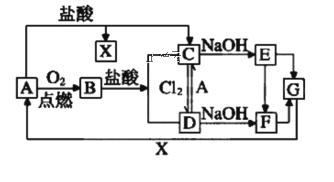
(1)写出A、B、D、E的化学式:A___、B___、D___、E___。
(2)检验D中阳离子的方法:___。
(3)保存C溶液时为什么加固体A___。
(4)写出下列转化的离子方程式
①C→E___。
②A→C___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含砷氧化铜矿[含CuO、Cu2(OH)2CO3、As2O3及重金属盐等]制取Cu2(OH)2SO4的工艺流程如下:
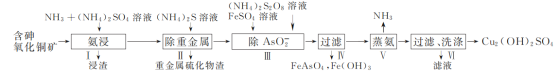
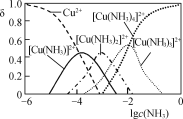
(1) 步骤Ⅰ“氨浸”时,控制温度为50~55 ℃,pH约为9.5,含铜化合物转化为[Cu(NH3)4]SO4溶液。
① CuO被浸取的离子方程式为________。
②浸取温度不宜超过55 ℃,其原因是________。
③ Cu2+与NH3结合时,溶液中含铜微粒的物质的量分布分数(δ)与溶液中游离的c(NH3)的对数值的关系如图所示。若用1 L浸取液(由等物质的量NH3和NH4+组成)将amolCu2(OH)2CO3全部浸出为[Cu(NH3)4]2+(CO32-转变为HCO3-,不考虑其他反应,溶液体积变化忽略不计),原浸取液中起始时c(NH3)应满足的条件是________。
(2) “除AsO2-”时,FeSO4需过量,一方面使AsO2-沉淀完全,另一目的是________。
(3) “蒸氨”时发生反应的化学方程式为________。
(4) 为了实现生产过程中物质循环利用,可采取的措施为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有效去除废水中的H2SiF6、F-,改善水质是环境部门的重要研究课题。
(1)AlF3是有机合成中常用催化剂,利用废水中的H2SiF6可转变制得,相关的热化学方程式如下:
3H2SiF6(aq)+2Al(OH)3(s)=Al2(SiF6)3(aq)+6H2O(l);ΔH=akJ·mol-1
Al2(SiF6)3(aq)+6H2O(l)=2AlF3(aq)+3SiO2(s)+12HF(aq);ΔH=bkJ·mol-1
3HF(aq)+Al(OH)3(s)=AlF3(aq)+3H2O(l);ΔH=ckJ·mol-1
则反应H2SiF6(aq)+2Al(OH)3(s)=2AlF3(aq)+SiO2(s)+4H2O(l)的ΔH=__kJ·mol-1。
(2)废水的酸碱度及废水中的Fe3+对F-浓度的测定都会产生一定的影响。
①测定时,通常控制废水的pH在5~6之间。pH过小所测F-浓度偏低,其原因是__。
②Fe3+与柠檬酸根(C6F5O73-)、F-反应可表示为Fe3++nC6H5O73-![]() Fe(C6H5O7)n(3n-3)-、Fe3++nF-
Fe(C6H5O7)n(3n-3)-、Fe3++nF-![]() FeFn(3-n)。向含有Fe3+的含氟废水中加入柠檬酸钠(C6H5O7Na3)可消除Fe3+对F-测定的干扰,其原因是__。
FeFn(3-n)。向含有Fe3+的含氟废水中加入柠檬酸钠(C6H5O7Na3)可消除Fe3+对F-测定的干扰,其原因是__。
(3)利用聚苯胺可吸附去除水中F-。用惰性电极电解苯胺(![]() )和盐酸的混合液可在阳极获得聚苯胺薄膜,变化过程如图:
)和盐酸的混合液可在阳极获得聚苯胺薄膜,变化过程如图:
![]()
写出阳极生成二聚体的电极反应方程式:___。
(4)利用MgCO3、Ca(OH)2和CaCO3等可沉淀去除废水中F-。
①以MgCl2溶液、尿素[CO(NH2)2]为原料可制得MgCO3,写出该反应的化学方程式:__。
②取三份相同的含F-的酸性废水,分别加入足量的MgCO3、Ca(OH)2和CaCO3。相同时间后溶液的pH及F-残留量如图1所示。实际废水处理过程中常选用MgCO3的理由是:__。
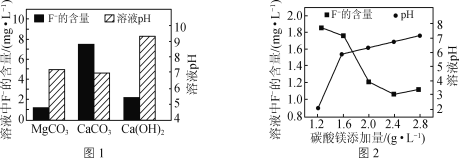
③改变碳酸镁添加量,处理后废水中F-含量及溶液pH的变化如图2所示。添加量超过2.4g·L-1后,F-含量略有升高的原因是___。{Ksp(MgF2)=7.4×10-11,Ksp[Mg(OH)2]=5.6×10-12}
查看答案和解析>>
科目:高中化学 来源: 题型:
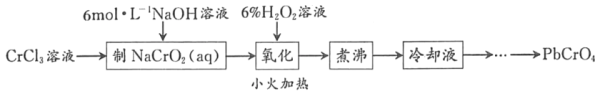
【题目】PbCrO4是一种黄色颜料,制备PbCrO4的一种实验步骤如图1:
已知:①Cr(OH)3(两性氢氧化物)呈绿色且难溶于水
②Pb(NO3)2、Pb(CH3COO)2均易溶于水,PbCrO4的Ksp为2.8×10﹣13,Pb(OH)2开始沉淀时pH为7.2,完全沉淀时pH为8.7。
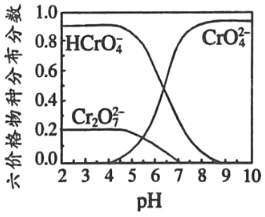
③六价铬在溶液中物种分布分数与pH关系如图2所示。
④PbCrO4可由沸腾的铬酸盐溶液与铅盐溶液作用制得,含PbCrO4晶种时更易生成
(1)实验时需要配置100mL3molL﹣1CrCl3溶液,现有量筒、玻璃棒、烧杯,还需要玻璃仪器是___。
(2)“制NaCrO2(aq)”时,控制NaOH溶液加入量的操作方法是_____。
(3)“氧化”时H2O2滴加速度不宜过快,其原因是_____;“氧化”时发生反应的离子方程式为___。
(4)“煮沸”的目的是_____。
(5)请设计用“冷却液”制备PbCrO4的实验操作:_____[实验中须使用的试剂有:6molL﹣1的醋酸,0.5molL﹣1Pb(NO3)2溶液,pH 试纸]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些难溶性铅盐可用作涂料,如秦俑彩绘中使用的铅白(PbCO3)和黄金雨中黄色的PbI2。室温下,PbCO3 和 PbI2 在不同的溶液中分别达到溶解平衡时-lgc(Pb2+)与-lgc(CO32-)或-lgc(I-)的关系如图所示。下列说法错误的是
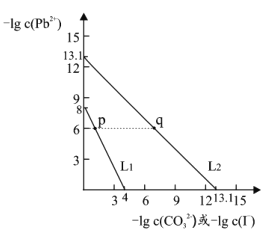
A.Ksp(PbCO3)的数量级为 10-14
B.相同条件下,水的电离程度 p 点大于 q 点
C.L1 对应的是-lgc(Pb2+)与-lgc(I-)的关系变化
D.p 点溶液中加入 Na2CO3 浓溶液,可得白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把盛有几小块镁片的试管放入盛有25℃的饱和石灰水的烧杯中,再用滴管向试管中滴入2 mL的稀盐酸。下列对烧杯中的实验现象的描述及原因说明正确的是( )
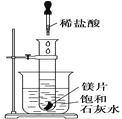
A. 烧杯中出现白色浑浊,原因是试管中的反应放出热量使烧杯中饱和石灰水温度升高,溶质析出
B. 烧杯中出现白色浑浊,原因是试管中的反应吸收热量使烧杯中饱和石灰水温度降低,溶质析出
C. 烧杯中没有任何现象,原因是试管中的反应对烧杯中饱和石灰水不会产生任何影响
D. 烧杯中没有任何现象,原因是试管中的反应既不放出热量,也不吸收热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在某2 L恒容密闭容器中加入纳米级氧化亚铜并通入0.1 mol 水(g),发生如下反应:2H2O(g)![]() 2H2(g)+O2(g) ΔH=+484 kJ·mol-1。不同时间产生O2的物质的量见下表:
2H2(g)+O2(g) ΔH=+484 kJ·mol-1。不同时间产生O2的物质的量见下表:

下列说法不正确的是( )
A. 前20 min内的平均反应速率v(H2O)=5×10-5mol·L-1·min-1
B. 达到平衡时,需要从外界吸收的能量为0.968 kJ
C. 增大水的浓度,可以改变待反应的限度
D. 使用纳米级的氧化亚铜,可以增大平衡时氧气的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题
(1)镁燃烧不能用CO2灭火,用化学方程式表示其理由________________________________。
(2)铝制品不能盛放碱性食品原因用离子方程式表示________________________________。
(3)不能用带磨口玻璃塞的试剂瓶盛装碱液的原因用离子方程式表________________________________。
(4)有一种石棉矿叫做青石棉,其化学式为Na2Fe5Si8H2O24,写成氧化物形式的化学式为____________。
(5)已知CuCL是白色难溶的物质,写出CuCL2溶液与SO2反应的离子方程式________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com