
【题目】工业所需氢气大部分由化学法制得,制取出过程中不可避免的会产生副产物CO、CO2、H2S等,CO选择性催化甲烷化技术可实现CO转化为CH4和H2O以达到净化氢气的目的。富氢气氛中CO和CO2甲烷化反应:
CO(g)+3H2(g)![]() CH4(g)+H2O(g)△H=-206.2kJmol-1
CH4(g)+H2O(g)△H=-206.2kJmol-1
CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)△H=-165.0kJmol-1
CH4(g)+2H2O(g)△H=-165.0kJmol-1
回答下列问题:
(1)CO的转化率(![]() )及H2对CO的选择性(
)及H2对CO的选择性(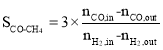 )是衡量工艺优劣的重要指标。其中nco,in及
)是衡量工艺优劣的重要指标。其中nco,in及![]() 分别为反应器入口CO、H2物质的量;nco,out及
分别为反应器入口CO、H2物质的量;nco,out及![]() 分别为反应器出口CO、H2的物质的量。
分别为反应器出口CO、H2的物质的量。
①以一定流速将富氢(含CO和CO2通过反应器 ,温度低于250℃时,在Ni-ZrO2-SiO2催化剂表面CO和CO2甲烷化速率均随温度升高而增大,则该温度范围内XCO将________(填“增大”“减小”或“无法判断”)。
②温度高于270℃反应CO2速率迅速增加,此时H2对CO的选择性开始________(填“升高”“下降”或“不变”)。
(2)恒温恒容条件下H2S发生分解反应,2H2S(g)![]() 2H2(g)+S2(g),初始投入2molH2S和1moH2,容器中的压强为p,一段时间后反应达到平衡,H2S的物质的量为1mol。
2H2(g)+S2(g),初始投入2molH2S和1moH2,容器中的压强为p,一段时间后反应达到平衡,H2S的物质的量为1mol。
①则初始时H2S的分压为________ 。
②该反应的Kp=________(Kp表示分压平衡常数,分压=总压×物质的量分数)。
(3)甲烷化过程中H2S会使催化剂中毒,下是图3个H2S在催化剂表面逐步解离的能量变化图:
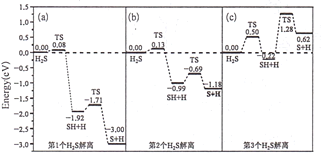
注:TS表示过渡状态
①(c)图中H2S的解离分为________步,决定分解速率快慢的是第________步.
②(b)图SH解离为硫原子和氢原子的反应热为________eV.
③Prodhomme研究发现H2S的解离难易与硫原子在催化剂表面吸附的多少有一定关系,观察上图预测该关系为________。
【答案】增大 下降 ![]() p
p ![]() p 二 二 -0.19 催化剂表面吸附的硫原子越多,越不利于H2S解离
p 二 二 -0.19 催化剂表面吸附的硫原子越多,越不利于H2S解离
【解析】
(1)反应达到平衡之前,温度越高反应越快,反应物的转化率越大;根据反应条件判断改变温度的时候,哪个反应受温度的影响比较大;
(2)根据反应前后反应物、生成物的变化量之比等于化学计量数之比,计算出平衡时反应物、生成物的物质的量,然后根据恒温恒容的容器中,压强之比等于物质的量之比,计算出反应后容器的总压强,根据分压=总压×物质的量分数,计算出平衡时反应物、生成物各自的分压,最后计算分压平衡常数;
(3)从图中找出H2S解离的过程,每一步解离能量的变化,反应的快慢取决于能垒比较高的,能垒越高反应速率越慢;根据反应热=生成物的总能量-反应物的总能量。
(1)①温度低于250℃时,在Ni-ZrO2-SiO2催化剂表面CO和CO2甲烷化速率均随温度升高而增大,说明温度低于250℃时,反应未达到平衡,故升高温度,化学反应速率加快,CO的转化率增大;
②温度高于270℃反应CO2速率迅速增加,则CO2和H2的转化率增大,c(H2)减小、c(CH4)增大,导致反应CO(g)+3H2(g) ![]() CH4(g)+H2O(g)的平衡逆向移动,CO的转化率降低,即nco,in—nco,out减小,
CH4(g)+H2O(g)的平衡逆向移动,CO的转化率降低,即nco,in—nco,out减小,![]() —
—![]() 增大,则H2对CO的选择性下降;
增大,则H2对CO的选择性下降;
(2)①初始投入2molH2S和1moH2,容器中的压强为p,则初始时H2S的分压为![]() p;
p;
②反应2H2S(g) ![]() 2H2(g)+S2(g),初始投入2molH2S和1moH2,容器中的压强为p,一段时间后反应达到平衡,H2S的物质的量为1mol,则反应消耗H2S的物质的量为2mol-1mol=1mol,根据化学反应中反应物、生成物的物质的量变化之比等于化学计量数之比,故平衡时生成的H2、S2的物质的量分别为1mol、0.5mol,故平衡后H2、S2的物质的量分别为1mol+1mol=2mol,0.5mol。恒温恒容条件下,反应前后压强之比等于总物质的量之比,令平衡后容器中的总压强为p1,则p:p1=3:(1+2+0.5),p1=
2H2(g)+S2(g),初始投入2molH2S和1moH2,容器中的压强为p,一段时间后反应达到平衡,H2S的物质的量为1mol,则反应消耗H2S的物质的量为2mol-1mol=1mol,根据化学反应中反应物、生成物的物质的量变化之比等于化学计量数之比,故平衡时生成的H2、S2的物质的量分别为1mol、0.5mol,故平衡后H2、S2的物质的量分别为1mol+1mol=2mol,0.5mol。恒温恒容条件下,反应前后压强之比等于总物质的量之比,令平衡后容器中的总压强为p1,则p:p1=3:(1+2+0.5),p1=![]() ,平衡后的分压p(H2S)=
,平衡后的分压p(H2S)=![]() ,p(H2)=
,p(H2)=![]() ,p(S2)=
,p(S2)=![]() ,Kp=
,Kp=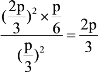 ;
;
(3)①由图(c)可知,H2S的解离分为两个过程:H2S →HS+S,HS →H+S,第二步能垒高,反应进行比较慢,决定整个反应的快慢,
②由图(b)可知HS解离为硫原子和氢原子为第二步过程,反应热为-1.18eV-(-0.99eV)=-0.19eV;
③由图(a)、(b)、(c)可知,解离第一个H2S的反应热为-3.0eV,解离第二个H2S的反应热为-1.18eV,解离第三个H2S的反应热为+0.62eV,即催化剂表面吸附的S原子越多,H2S的解离越难。


科目:高中化学 来源: 题型:
【题目】用含砷氧化铜矿[含CuO、Cu2(OH)2CO3、As2O3及重金属盐等]制取Cu2(OH)2SO4的工艺流程如下:
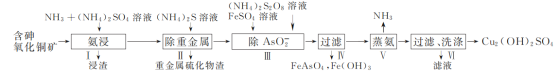
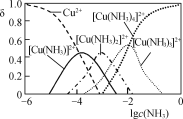
(1) 步骤Ⅰ“氨浸”时,控制温度为50~55 ℃,pH约为9.5,含铜化合物转化为[Cu(NH3)4]SO4溶液。
① CuO被浸取的离子方程式为________。
②浸取温度不宜超过55 ℃,其原因是________。
③ Cu2+与NH3结合时,溶液中含铜微粒的物质的量分布分数(δ)与溶液中游离的c(NH3)的对数值的关系如图所示。若用1 L浸取液(由等物质的量NH3和NH4+组成)将amolCu2(OH)2CO3全部浸出为[Cu(NH3)4]2+(CO32-转变为HCO3-,不考虑其他反应,溶液体积变化忽略不计),原浸取液中起始时c(NH3)应满足的条件是________。
(2) “除AsO2-”时,FeSO4需过量,一方面使AsO2-沉淀完全,另一目的是________。
(3) “蒸氨”时发生反应的化学方程式为________。
(4) 为了实现生产过程中物质循环利用,可采取的措施为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把盛有几小块镁片的试管放入盛有25℃的饱和石灰水的烧杯中,再用滴管向试管中滴入2 mL的稀盐酸。下列对烧杯中的实验现象的描述及原因说明正确的是( )
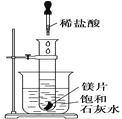
A. 烧杯中出现白色浑浊,原因是试管中的反应放出热量使烧杯中饱和石灰水温度升高,溶质析出
B. 烧杯中出现白色浑浊,原因是试管中的反应吸收热量使烧杯中饱和石灰水温度降低,溶质析出
C. 烧杯中没有任何现象,原因是试管中的反应对烧杯中饱和石灰水不会产生任何影响
D. 烧杯中没有任何现象,原因是试管中的反应既不放出热量,也不吸收热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在某2 L恒容密闭容器中加入纳米级氧化亚铜并通入0.1 mol 水(g),发生如下反应:2H2O(g)![]() 2H2(g)+O2(g) ΔH=+484 kJ·mol-1。不同时间产生O2的物质的量见下表:
2H2(g)+O2(g) ΔH=+484 kJ·mol-1。不同时间产生O2的物质的量见下表:

下列说法不正确的是( )
A. 前20 min内的平均反应速率v(H2O)=5×10-5mol·L-1·min-1
B. 达到平衡时,需要从外界吸收的能量为0.968 kJ
C. 增大水的浓度,可以改变待反应的限度
D. 使用纳米级的氧化亚铜,可以增大平衡时氧气的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池发电站,与普通火力发电站相比,其有害物排放少,运行噪音低,被誉为“绿色”发电站。如图为某空气燃料电池工作原理,下列说法错误的是
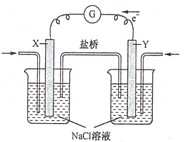
A.该电池工作时,X电极附近的溶液pH升高
B.该电池工作时,盐桥中的阴离子向Y电极移动
C.若用甲醇作燃料,则X电极上的反应为CH3OH-6e-+H2O=CO2+6H+
D.若用甲烷作燃料,当电路中通过0.8mol电子时,则消耗甲烷的质量为1.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过测定反应过程中所放出的热量可计算中和热。50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在图示的装置中进行中和反应.回答下列问题:
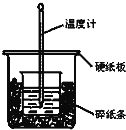
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是___________.
(2)大烧杯上如果不盖硬纸板,求得的中和热数值__________(填“偏大”,“偏小”或“无影响”).
(3)实验中改用60mL 0.50mol/L盐酸跟50mL 0.55mol/LNaOH溶液进行反应,与上述实验相比,所求中和热________(填“相等”“不相等”),简述理由:______________________.
(4)若两溶液的密度都是1g/mL,中和后所得溶液的比热容c=4.18J/(g·℃),三次平行操作测得终止温度与起始温度差(t2﹣t1)分别为:①3.2℃ ②2.2℃ ③3.0℃,写出表示盐酸与NaOH溶液反应的中和热的热化学方程式________________________.(小数点后保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子方程式BaCO3 + 2H+ = CO2↑ + H2O + Ba2+ 中的H+不能代表的物质是( )
①HCl;②H2SO4;③HNO3;④NaHSO4;⑤CH3COOH
A.①③B.①④⑤C.②④⑤D.⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题
(1)镁燃烧不能用CO2灭火,用化学方程式表示其理由________________________________。
(2)铝制品不能盛放碱性食品原因用离子方程式表示________________________________。
(3)不能用带磨口玻璃塞的试剂瓶盛装碱液的原因用离子方程式表________________________________。
(4)有一种石棉矿叫做青石棉,其化学式为Na2Fe5Si8H2O24,写成氧化物形式的化学式为____________。
(5)已知CuCL是白色难溶的物质,写出CuCL2溶液与SO2反应的离子方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com