
����Ŀ������ʪ�����մ������ࣨ��Ҫ����Cu��Ag��Au)����ȡAg��Au��������ͼ��ʾ��
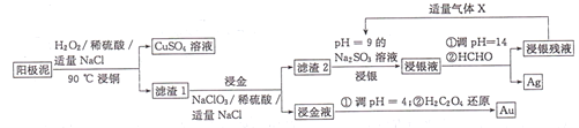
�ش��������⣺
��1������ͭ��ʱ��ͭ���뷴Ӧ�����ӷ���ʽΪ______________�����¶ȹ��ߣ�ͭ�Ľ����ʻή�ͣ�ԭ����______________��
��2��������Һ������Ҫ�ɷ���H[AuCl4]�����𡱲��跢����Ӧ�Ļ�ѧ����ʽΪNaCl+NaClO3+Au+H2SO4��Na2SO4+H2O+H[AuCl4](δ��ƽ�����÷�Ӧ���������뻹ԭ�����ʵ���֮��Ϊ______________,����ˮ��Ҳ���ܽ����ˮ�ijɷ�Ϊ______________��
��3���ӡ�����Һ������ȡ��ʱ�������ͻ�ԭ�������ʵ���֮��Ϊ______________��
��4����������ʱ������ӦAgCl+2SO32-![]() Ag(SO3)23-+C1-,Ag(SO3)23-��HCHO����ΪCO32-��������Һ����ͨ������X���ɵõ�Na2SO3����Һ��X�Ļ�ѧʽΪ______________��Na2SO3����Һ��ѭ��ʹ�ô��������Ľ����ʹ�ϵ��ͼ��ʾ��
Ag(SO3)23-+C1-,Ag(SO3)23-��HCHO����ΪCO32-��������Һ����ͨ������X���ɵõ�Na2SO3����Һ��X�Ļ�ѧʽΪ______________��Na2SO3����Һ��ѭ��ʹ�ô��������Ľ����ʹ�ϵ��ͼ��ʾ��

��ƽ���ƶ��ǶȽ����������ߵı仯ԭ��______________��
���𰸡�Cu+2H++H2O2=Cu2++2H2O �¶ȹ��ᵼ��H2O2�����ֽ� 1��2 1���Ũ�����3���Ũ���� 2 ��3 SO2 Na2SO3����Һ�к���Cl-.���ʹ��Na2SO3����Һ����۴���Cl-��c(Cl-)����ʹAgCl+2SO32-![]() Ag(SO3)23-+Cl-ƽ�������ƶ���������AgCl���ܽ�
Ag(SO3)23-+Cl-ƽ�������ƶ���������AgCl���ܽ�
��������
�������ͼ�е���Ϣ���ڽ�ͭ�����У�H2O2������������ͭ���ʣ�����1ΪAg��Au������2ΪAgCl��������Һ������Ҫ�ɷ���H[AuCl4]��AgCl��pH=9��Na2SO3��Һ��Ӧ����Ag(SO3)23-��Ag(SO3)23-��HCHO����������ԭ��Ӧ����Ag��H[AuCl4]��H2C2O4��ԭΪAu�������漰������ԭ��Ӧ����ʽ��ƽ���������뻹ԭ�������ʵ���֮�ȶ�����������ԭ��Ӧ�е�ʧ�����غ�ķ���ȥ����
��1���ڽ�ͭ�����У�H2O2������������ͭ������Һ�з�Ӧ�����ӷ���ʽΪCu+2H++H2O2=Cu2++2H2O�����¶ȹ��ߣ�H2O2���ȷֽ��������ʵ����ҪH2O2����ҪԶԶ��������Ҫ����������������ͭ�Ľ����ʻή�ͣ�
��2����Ӧ��ClԪ�ػ��ϼ���+5�۽���Ϊ-1�ۣ�NaClO3����������Au��0�����ߵ�+3�ۣ�Au����ԭ��������������ԭ��Ӧ�л��ϼ�����������ȣ��ʸ÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ1��2������ˮ��Ҳ�����ܽ����ˮ�ijɷ�Ϊ1���Ũ�����3���Ũ���
��3������Һ����Ҫ�ɷ�Ϊ[AuCl4]-��[AuCl4]-��AuԪ�صĻ��ϼ�Ϊ+3�ۣ�1mol[AuCl4]-����ԭΪAu���õ�3mol���ӣ�[AuCl4]-�ڷ�Ӧ������������H2C2O4�ڷ�Ӧ��CԪ�صĻ��ϼ�Ϊ+3�ۣ�H2C2O4������ΪCO2��CO2��CԪ�صĻ��ϼ�Ϊ+4�ۣ�H2C2O4����ԭ������1molH2C2O4������Ϊ2molCO2ʧȥ2mol���ӣ�����������ԭ��Ӧ�е�ʧ�����غ㣬��������Һ������ȡ��ʱ�������ͻ�ԭ�������ʵ���֮��Ϊ2:3��
��4��Ϊ���ٷ�Һ���ŷţ����������Դ��������ҺpHԼΪ14��ͨ��SO2�õ�Na2SO3����Һ����������ʱ������ӦAgCl+2SO32-![]() Ag(SO3)23-+C1-���÷�ӦΪ���淴Ӧ��Na2SO3����Һ�к���Cl-�����ʹ��Na2SO3����Һ����۴���Cl-��c(Cl-)����ʹAgCl+2SO32-
Ag(SO3)23-+C1-���÷�ӦΪ���淴Ӧ��Na2SO3����Һ�к���Cl-�����ʹ��Na2SO3����Һ����۴���Cl-��c(Cl-)����ʹAgCl+2SO32-![]() Ag(SO3)23-+Cl-ƽ�������ƶ���������AgCl���ܽ⣬�������Ľ������½���
Ag(SO3)23-+Cl-ƽ�������ƶ���������AgCl���ܽ⣬�������Ľ������½���


 ��У��������ĩ��̾�ϵ�д�
��У��������ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ӽױ����������������̿��Ժϳɱ����ᱽ������ˮ���ᡣ
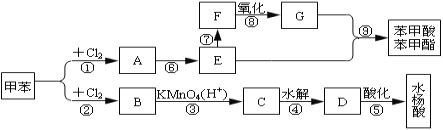
��֪ˮ����Ľṹ��ʽΪ![]() �ҷ��ǻ��ױ���������ش�
�ҷ��ǻ��ױ���������ش�
��1��д�����з�Ӧ����������_____________����_______��
��2��C��F�Ľṹ��ʽ�ֱ�Ϊ��C___��F___��
��3��д����Ӧ�ޡ���Ļ�ѧ����ʽ����________________��_____
��4��д����Ӧ���ͣ���____________ ��____________ ��______________
��5���ۡ���������Ӧ�ܷ���Ϊʲô��___��
��6��д��ˮ�����ͬ���칹�����������Ľṹ��ʽ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijЩ������Ǧ�ο�����Ϳ�ϣ�����ٸ�ʻ���ʹ�õ�Ǧ��(PbCO3)�ͻƽ����л�ɫ��PbI2�������£�PbCO3 �� PbI2 �ڲ�ͬ����Һ�зֱ�ﵽ�ܽ�ƽ��ʱ-lgc(Pb2+)��-lgc(CO32-)��-lgc(I-)�Ĺ�ϵ��ͼ��ʾ������˵���������
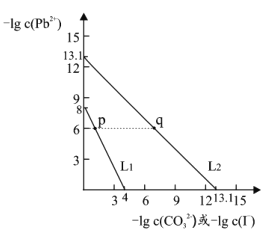
A.Ksp(PbCO3)��������Ϊ 10-14
B.��ͬ�����£�ˮ�ĵ���̶� p ����� q ��
C.L1 ��Ӧ����-lgc(Pb2+)��-lgc(I-)�Ĺ�ϵ�仯
D.p ����Һ�м��� Na2CO3 Ũ��Һ���ɵð�ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ֽ�����ĩA��B�ֱ���ͬŨ�ȵ�����ϡ���ᷴӦ��������+2�۽����Ȼ���䷴Ӧ�����ͼ��ʾ��
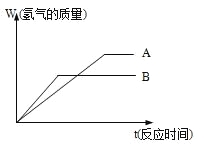
(1) ���ֽ����Ļ��˳����_____>______
���ֽ����Ȼ����Ħ��������_____>______
(2) �����ֽ�����ĩ��һ��������Ϻ��мס���
������ʵ�飬����ʵ���ȡ500mLͬŨ�ȵ�����
��Һ������ֻ�Ϸ�ĩ���������壬�й��������£�
ʵ����� | �� | �� | �� |
��Ϸ�ĩ����(g) | 6.2 | 18.6 | 24.8 |
������������(mL) | 2240 | 5600 | 5600 |
������ʵ���У�����________(��������������������������������)
���������õ���������ʵ���Ũ��Ϊ_____mol/L����Ϸ�ĩ��ƽ��Ħ��������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���ij2 L�����ܱ������м�������������ͭ��ͨ��0.1 mol ˮ(g)���������·�Ӧ��2H2O(g)![]() 2H2(g)��O2(g)����H����484 kJ��mol��1����ͬʱ�����O2�����ʵ������±���
2H2(g)��O2(g)����H����484 kJ��mol��1����ͬʱ�����O2�����ʵ������±���

����˵������ȷ����(����)
A. ǰ20 min�ڵ�ƽ����Ӧ����v(H2O)��5��10��5mol��L��1��min��1
B. �ﵽƽ��ʱ����Ҫ��������յ�����Ϊ0.968 kJ
C. ����ˮ��Ũ�ȣ����Ըı����Ӧ����
D. ʹ��������������ͭ����������ƽ��ʱ�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.lmolL-1������ζ�10.0mL0.lmolL-1Na2A��Һ�����õζ�������ͼ��ʾ������˵����ȷ����
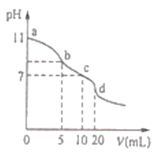
A.�����£�A2-��ˮ�ⳣ��Khl(A2-����������Ϊ10-6
B.b����Һ�У�c(HA-)+2c(H2A)+c(H+)=c(Cl-)+c(OH-)
C.c����Һ�У�c(HA-)+c(A2-)+c(H2A)=0.lmolL-1
D.d����Һ�У�c(A2-)+c(HA-)=c((H+)<c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ�50mL 0.50mol/L������50mL 0.55mol/LNaOH��Һ��ͼʾ��װ���н����кͷ�Ӧ���ش��������⣺
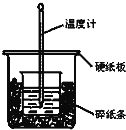
��1����ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ���������___________��
��2�����ձ����������Ӳֽ�壬��õ��к�����ֵ__________������ƫ��������ƫС��������Ӱ��������
��3��ʵ���и���60mL 0.50mol/L�����50mL 0.55mol/LNaOH��Һ���з�Ӧ��������ʵ����ȣ������к���________�������������������������������ɣ�______________________��
��4��������Һ���ܶȶ���1g/mL���кͺ�������Һ�ı�����c=4.18J/��g���棩������ƽ�в��������ֹ�¶�����ʼ�¶Ȳt2��t1���ֱ�Ϊ����3.2�� ��2.2�� ��3.0�棬д����ʾ������NaOH��Һ��Ӧ���к��ȵ��Ȼ�ѧ����ʽ________________________����С�������һλС����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л��������(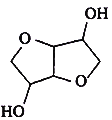 )��ͬ���칹��(�����������칹)��1.460g������������̼��������Һ��Ӧ���ų�448 mL CO2(��״����)������˵���������
)��ͬ���칹��(�����������칹)��1.460g������������̼��������Һ��Ӧ���ų�448 mL CO2(��״����)������˵���������
A.�ķ���ʽΪC6H10O4
B.�����ҿ��Է���������Ӧ
C.�ҵ�һ�ȴ�����3��
D.���ܵĽṹ����8��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ A �ǵ���,A��B��C��D��E �������ʾ���ͬһ��Ԫ��,X �ǵؿ��к�������Ԫ���γɵĵ��ʣ��ת����ϵ��ͼ��ʾ.�ش���������:

(1)ͨ�������,��AΪ����,C��D���Ǵ�����Ⱦ��;
��д�����з�Ӧ�Ļ�ѧ����ʽ
B![]() C_________________
C_________________
E![]() C_________________
C_________________
��ʵ�����м���B�IJ���������_________________��
�۱�״����,��ʢ��D���Թܵ�����ʢ��ˮ��ˮ����,һ��ʱ���,�ٶ����ʲ���ɢ,���Թ���������Һ�����ʵ���Ũ��Ϊ____________��
(2)ͨ�������,��AΪ����ɫ���壺
��д��B��C��Ӧ�Ļ�ѧ����ʽ��_______________________��
�ڽ�Cͨ����ˮ�е�������______��������Ӧ�����ӷ���ʽ��_______________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com