
【题目】有机物甲是乙(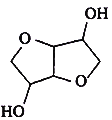 )的同分异构体(不考虑立体异构),1.460g甲与足量饱和碳酸氢钠溶液反应,放出448 mL CO2(标准状况下),下列说法错误的是
)的同分异构体(不考虑立体异构),1.460g甲与足量饱和碳酸氢钠溶液反应,放出448 mL CO2(标准状况下),下列说法错误的是
A.甲的分子式为C6H10O4
B.甲与乙可以发生酯化反应
C.乙的一氯代物有3种
D.甲可能的结构共有8种
科目:高中化学 来源: 题型:
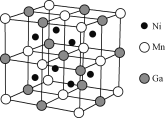
【题目】镍的单质、合金及其化合物用途非常广泛。
(1)Ni2+基态核外电子排布式为________。
(2)胶状镍可催化CH2=CHC≡N加氢生成CH3CH2C≡N。CH2=CHC≡N分子中σ键与π键的数目比n(σ)∶n(π)=________;CH3CH2C≡N分子中碳原子轨道的杂化类型为________。
(3)[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为______________________;[Ni(N2H4)2]2+中含四个配位键,不考虑空间构型,[Ni(N2H4)2]2+的结构可用示意图表示为______________________。
(4)一种新型的功能材料的晶胞结构如下图所示,它的化学式可表示为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用湿法工艺从阳极泥(主要含有Cu、Ag、Au)中提取Ag、Au的流程如图所示:
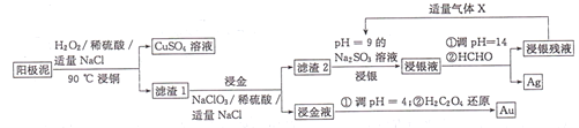
回答下列问题:
(1)“浸铜”时,铜参与反应的离子方程式为______________;若温度过高,铜的浸出率会降低,原因是______________。
(2)“浸金液”的主要成分是H[AuCl4],则“浸金”步骤发生反应的化学方程式为NaCl+NaClO3+Au+H2SO4→Na2SO4+H2O+H[AuCl4](未配平),该反应中氧化剂与还原剂物质的量之比为______________,“王水”也可溶解金,王水的成分为______________。
(3)从“浸金液”中提取金时氧化剂和还原剂的物质的量之比为______________。
(4)“浸银”时发生反应AgCl+2SO32-![]() Ag(SO3)23-+C1-,Ag(SO3)23-将HCHO氧化为CO32-。向“浸银残液”中通入气体X,可得到Na2SO3再生液,X的化学式为______________,Na2SO3再生液的循环使用次数与银的浸出率关系如图所示:
Ag(SO3)23-+C1-,Ag(SO3)23-将HCHO氧化为CO32-。向“浸银残液”中通入气体X,可得到Na2SO3再生液,X的化学式为______________,Na2SO3再生液的循环使用次数与银的浸出率关系如图所示:

从平衡移动角度解释上述曲线的变化原因:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确,且存在对应关系的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将NaOH溶液逐滴滴加到AlC13溶液中至过量 | 先产生白色胶状沉淀,后沉淀溶解 | Al(OH)3是两性氢氧化物 |
B | NaHCO3溶液与NaAlO溶液混合 | 生成白色沉淀 | 结合H+的能力:CO32->AlO2- |
C | 向盛有Na2SiO3,溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至过量 | 试管中红色逐渐褪去,出现白色凝胶 | 非金属性:Cl>Si |
D |
| 白色固体先变为淡黄色,后变为黄色 | 溶度积常数:Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI) |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼金属铝。下列说法错误的是( )
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
A. ①中还需要进行过滤操作,滤渣为二氧化硅
B. a、b中铝元素的存在形式不同
C. ③中需要通入过量的氨气
D. ④进行的操作是加热,而且d一定是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,pH 均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH 随溶液体积的变化曲线如图所示。下列说法正确的是

A. HA的酸性比HB的酸性弱
B. a点溶液的导电性比c点溶液的导电性弱
C. 若两溶液加水稀释,则所有离子的浓度都减小
D. 对a、b两点溶液同时升高温度,则c(A-)/c(B-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1 mol的镁、铝混合物溶于100 mL 2mol·L-1H2SO4溶液中,然后再滴加1 mol·L-1NaOH溶液。请回答:
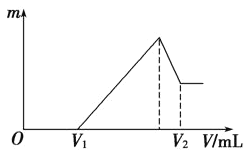
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示。当V1=120mL时,则金属粉末中n(Mg)=________,V2=________mL。
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=________mL。
(3)若向300mL 1 mol/LAL2(SO4)3的溶液中逐渐加入浓度为1mol/L的![]() 溶液,若产生2.34克白色沉淀,则加入的NaOH溶液的体积可能为__________毫升。
溶液,若产生2.34克白色沉淀,则加入的NaOH溶液的体积可能为__________毫升。
(4)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol·L-1硫酸溶解此混合物后,再加入460 mL 1 mol·L-1NaOH溶液,所得沉淀中无Al(OH)3。满足条件的a的取值范围是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中:按CO2与H2的物质的量之比为1:3进行投料,发生反应2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) △H<0,在5MPa 下测得不同温度下平衡体系中各种物质的体积分数 ( V% ) 如图所示,下列说法中正确的是
CH3CH2OH(g)+3H2O(g) △H<0,在5MPa 下测得不同温度下平衡体系中各种物质的体积分数 ( V% ) 如图所示,下列说法中正确的是
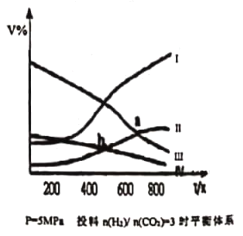
A.表示CH3CH2OH组分的曲线是IV
B.图中曲线交点a、b 对应的上述反应平衡常数Ka > Kb
C.图中曲线交点a 对应的 CO2 转化率为 40%
D.若甲、乙两个密闭容器起始时的容积、温度及投料方式均相同,甲:恒温恒压,乙;恒温恒容,反应达平衡时CH3CH2OH产率:甲<乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,及一定量的Fe2O3、MgO和CaO等。由该矿石制Co2O3的部分工艺流程如下:
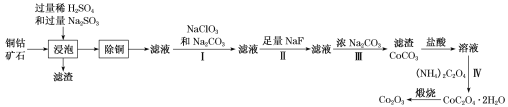
回答下列问题:
(1)“浸泡”过程中,钴(III)可转化为CoSO4,写出该转化的化学方程式:________。
(2)“除铜”若选用MnS,计算常温下该“除铜”反应的平衡常数K=________。[保留2位有效数字;已知常温下Ksp(MnS)=2.5×10–13,Ksp(CuS)=1.3×10–36]
(3)①步骤I中加入NaClO3反应的离子方程式为_______。
②常温下,溶液中金属离子(Mn+)的pM[pM=–lgc(Mn+)]随溶液pH变化关系如图所示,设加入NaClO3后,溶液中的c(CO2+)为0.1molL–1,依据如图分析,步骤I中加入Na2CO3调整溶液pH范围为_____。[当c(Mn+)≤10–6 molL–1,即认为该金属离子沉淀完全]

(4)步骤II中加入足量NaF的目的是________。
(5)过滤出的CoC2O42H2O固体经洗涤后,证明固体已洗净的操作为________。
(6)若某工厂用m1kg该铜钴矿石制备了m2kgCo2O3,假设产率为a,则该矿石中钴元素的百分含量为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com