
����Ŀ������ʵ�����������ͽ��۾���ȷ���Ҵ��ڶ�Ӧ��ϵ����
ѡ�� | ʵ����� | ʵ������ | ���� |
A | ��NaOH��Һ��εμӵ�AlC13��Һ�������� | �Ȳ�����ɫ��״������������ܽ� | Al(OH)3�������������� |
B | NaHCO3��Һ��NaAlO��Һ��� | ���ɰ�ɫ���� | ���H+��������CO32->AlO2- |
C | ��ʢ��Na2SiO3����Һ���Թ��еμ�1�η�̪��Ȼ����μ���ϡ���������� | �Թ��к�ɫ����ȥ�����ְ�ɫ���� | �ǽ����ԣ�Cl>Si |
D |
| ��ɫ�����ȱ�Ϊ����ɫ�����Ϊ��ɫ | �ܶȻ�������Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI) |
A.AB.BC.CD.D
���𰸡�D
��������
A����ʼNaOH����������������������������������������������������������������Ӧ�����ܽ⣬��û�����������������ܺ��ᷴӦ�����ܺͼӦ��ʵ�鲻��˵�����������������ԣ���A����
B��������ӦHCO3-+AlO2-+H2O=Al(OH)3��+ CO32-������ΪAlO2-�����HCO3-���������H+������H+��������CO32-��AlO2-����B����
C��Ԫ�صķǽ�����Խǿ��������������ˮ��������Խǿ��ǿ���ܺ������η�Ӧ�������ᣬ��HCl����ClԪ������������ˮ������Բ��ܱȽ�Cl��Si�ǽ�����ǿ������C����
D����ɫ�����ȱ�Ϊ����ɫ�����Ϊ��ɫ����������������ת���������ܶȻ���С�ij��������ܶȻ�ΪKsp(AgCl)>Ksp(AgBr)>Ksp(AgI)����D��ȷ��
��ѡD��


 ����ͼ���������������ϵ�д�
����ͼ���������������ϵ�д� ����ѧҵ���Ե�����ϵ�д�
����ѧҵ���Ե�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.�����£���ӦNH3(g)+HCl(g)=NH4Cl(s)���Է�������Ӧ����÷�Ӧ�ġ�H>0
B.�����£������ʵ���Ũ�ȵ�CH3COOH��Һ��HCl��Һ�У�ˮ�ĵ���̶���ͬ
C.�����£�0.1molL��1CH3COONa��Һ��ˮϡ�ͺ���Һ��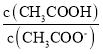 ��ֵ����
��ֵ����
D.�����£���BaCO3��BaSO4�ı�����Һ�м�������BaCl2���壬��Һ��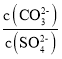 ��С
��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ֽ�����ĩA��B�ֱ���ͬŨ�ȵ�����ϡ���ᷴӦ��������+2�۽����Ȼ���䷴Ӧ�����ͼ��ʾ��
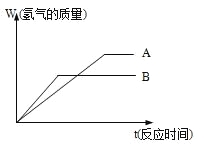
(1) ���ֽ����Ļ��˳����_____>______
���ֽ����Ȼ����Ħ��������_____>______
(2) �����ֽ�����ĩ��һ��������Ϻ��мס���
������ʵ�飬����ʵ���ȡ500mLͬŨ�ȵ�����
��Һ������ֻ�Ϸ�ĩ���������壬�й��������£�
ʵ����� | �� | �� | �� |
��Ϸ�ĩ����(g) | 6.2 | 18.6 | 24.8 |
������������(mL) | 2240 | 5600 | 5600 |
������ʵ���У�����________(��������������������������������)
���������õ���������ʵ���Ũ��Ϊ_____mol/L����Ϸ�ĩ��ƽ��Ħ��������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.lmolL-1������ζ�10.0mL0.lmolL-1Na2A��Һ�����õζ�������ͼ��ʾ������˵����ȷ����
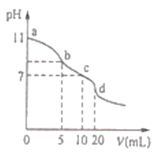
A.�����£�A2-��ˮ�ⳣ��Khl(A2-����������Ϊ10-6
B.b����Һ�У�c(HA-)+2c(H2A)+c(H+)=c(Cl-)+c(OH-)
C.c����Һ�У�c(HA-)+c(A2-)+c(H2A)=0.lmolL-1
D.d����Һ�У�c(A2-)+c(HA-)=c((H+)<c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ�50mL 0.50mol/L������50mL 0.55mol/LNaOH��Һ��ͼʾ��װ���н����кͷ�Ӧ���ش��������⣺
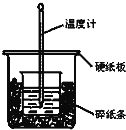
��1����ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ���������___________��
��2�����ձ����������Ӳֽ�壬��õ��к�����ֵ__________������ƫ��������ƫС��������Ӱ��������
��3��ʵ���и���60mL 0.50mol/L�����50mL 0.55mol/LNaOH��Һ���з�Ӧ��������ʵ����ȣ������к���________�������������������������������ɣ�______________________��
��4��������Һ���ܶȶ���1g/mL���кͺ�������Һ�ı�����c=4.18J/��g���棩������ƽ�в��������ֹ�¶�����ʼ�¶Ȳt2��t1���ֱ�Ϊ����3.2�� ��2.2�� ��3.0�棬д����ʾ������NaOH��Һ��Ӧ���к��ȵ��Ȼ�ѧ����ʽ________________________����С�������һλС����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.Na2O2����ʪ�����ɫʯ����ֽ��ʯ����ֽ���ձ����ɫ
B.Na2O2�����������Ӻ������Ӹ�����Ϊ2:1
C.Na2O2��CO2��Ӧ����0.1 mol O2ʱת�Ƶ���0.4 mol
D.���ռ���Һ�м���2 g Na2O2����ַ�Ӧ�����Һ��c(Na��)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л��������(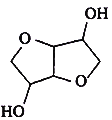 )��ͬ���칹��(�����������칹)��1.460g������������̼��������Һ��Ӧ���ų�448 mL CO2(��״����)������˵���������
)��ͬ���칹��(�����������칹)��1.460g������������̼��������Һ��Ӧ���ų�448 mL CO2(��״����)������˵���������
A.�ķ���ʽΪC6H10O4
B.�����ҿ��Է���������Ӧ
C.�ҵ�һ�ȴ�����3��
D.���ܵĽṹ����8��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�����Ŷ���̬�������Ļ�����ڹ�ũҵ����������Ҫ��Ӧ�á�
(1)ͬ����Ԫ���У��ȵ�Ԫ�صĵ�һ�����ܴ��Ԫ�ع���______________�֡�
(2)NF3�빯���ȿ��Ƶ�N2F2��
��NF3�ļ��ι���Ϊ______________��N2F2 �ЦҼ��ͦм��ĸ�����Ϊ_____________��
����֪��λ�ڵ������ڣ���пͬ�塣��̬��ԭ�ӵļ۵����Ų�ʽΪ_____________��
(3)H3N-BH3������Bԭ�ӵ��ӻ��������Ϊ_________���÷��ӵ��۷е������ߣ�ԭ����________________________��
(4)��B��N��FԪ����ɵ����ӻ������У�B��N��Fԭ�ӵĸ�����Ϊ1:1: 8,�����������ǵȵ�����,�û������е���������__________(�����ӷ���)��
(5)��������ṹ��ͼ��ʾ��
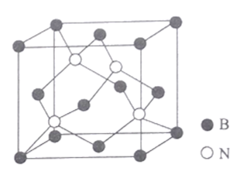
�ٸþ����к��е�����������Ϊ______________________��
��ͼ��Nԭ�ӵ��������Ϊ (![]() ��
��![]() ��
��![]() )��(
)��(![]() ��
��![]() ��
��![]() )��(
)��(![]() ��
��![]() ��
��![]() )��________��
)��________��
����֪BN���������������������ԭ�ӵĺ˼��Ϊacm��NAΪ�����ӵ�������ֵ.���ܶ�Ϊ_____________gcm-3 (�г�����ʽ����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Կ��淴Ӧ4NH3(g)��5O2(g) ![]() 4NO(g)��6H2O(g)������������ȷ����(����)
4NO(g)��6H2O(g)������������ȷ����(����)
A. �ﵽ��ѧƽ��ʱ4v��(O2)��5v��(NO)
B. ����λʱ��������x mol NO��ͬʱ������x mol NH3����Ӧ�ﵽƽ��״̬
C. �ﵽ��ѧƽ��ʱ�������������ݻ���������Ӧ���ʼ�С���淴Ӧ��������
D. ��ѧ��Ӧ���ʹ�ϵ��2v��(NH3)��3v��(H2O)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com