
【题目】下列说法正确的是( )
A.Na2O2遇到湿润的紫色石蕊试纸后,石蕊试纸最终变成蓝色
B.Na2O2晶体中阳离子和阴离子个数比为2:1
C.Na2O2与CO2反应生成0.1 mol O2时转移电子0.4 mol
D.向饱和烧碱溶液中加入2 g Na2O2,充分反应完后,溶液中c(Na+)不变
科目:高中化学 来源: 题型:
【题目】在①、②、③容积不等的恒容密闭容器中,均充入0.1molCO和0.2molH2,在催化剂的作用下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图所示:下列说法正确的是( )
CH3OH(g)。测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图所示:下列说法正确的是( )
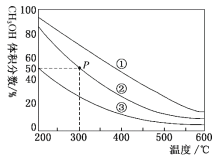
A.该反应的正反应为吸热反应
B.三个容器容积:①>②>③
C.在P点,CO转化率为75%
D.在P点,向容器②中再充入CO、H2及CH3OH各0.025mol,此时v(CO)正>v(CO)逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,所含分子数相同的是( )
A.10g H2 和10g O2B.9g H2O 和0.5mol Br2
C.5.6L N2(非标准状况)和11g CO2D.224mLH2 (标准状况)和0.1mol N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近一期《物理评论快报》报道了科学家成功制备了包含钙(Ca)、钾(K)、铁(Fe)和砷(As)以及少量镍(Ni)的新型化合物材料[CaK(Fe1-x一Nix)4As4).回答下列问题:
(1)基态镍原子的价层电子排布式为________,基态砷原子最高能级的电子云有________个伸展方向.
(2)亚铁氰化钾{K4[Fe(CN)6]}是食盐中广泛使用的抗结剂,化学式中涉及的所有元素的笫一电离能由小到大的顺序为________,[Fe(CN)6]4-中,铁提供的空轨道数目为________,气态化合物X与CN一互为等电子体,则X的化学式为________.
(3)AsCl3分子中砷的杂化类型为________;其空间构型为________。
(4)已知:CaO、K2S的熔点分别为2572℃、840℃,二者熔点差异的主要原因是________。
(5)镍和硫形成的某晶体.其晶胞如图所示.巳知该晶体密度为dgcm-3,NA为阿伏加德罗常数的值。则Ni、S原子最短核间距(D)为________________cm。
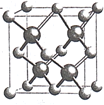
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确,且存在对应关系的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将NaOH溶液逐滴滴加到AlC13溶液中至过量 | 先产生白色胶状沉淀,后沉淀溶解 | Al(OH)3是两性氢氧化物 |
B | NaHCO3溶液与NaAlO溶液混合 | 生成白色沉淀 | 结合H+的能力:CO32->AlO2- |
C | 向盛有Na2SiO3,溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至过量 | 试管中红色逐渐褪去,出现白色凝胶 | 非金属性:Cl>Si |
D |
| 白色固体先变为淡黄色,后变为黄色 | 溶度积常数:Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI) |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,19g羟基(—18OH)中所含的中子数为9NA
B.常温下,1L pH=3的FeCl3溶液中由水电离出的H+的数目为0. 001 NA
C.标准状况下,NO和O2各11.2L 混合充分反应,所得气体的分子总数为0. 75 NA
D.足量的铜与40 mL10 mol/L硝酸反应,生成气体的分子数为0. 2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,pH 均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH 随溶液体积的变化曲线如图所示。下列说法正确的是

A. HA的酸性比HB的酸性弱
B. a点溶液的导电性比c点溶液的导电性弱
C. 若两溶液加水稀释,则所有离子的浓度都减小
D. 对a、b两点溶液同时升高温度,则c(A-)/c(B-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
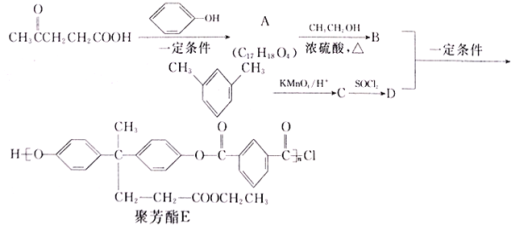
【题目】随着我国航天事业的飞速发展,对材料的需求也越来越多,聚芳酯(PAR)是分子主链上带来苯环和酯基的特种工程塑料,其结构简式为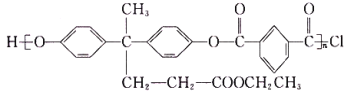 ,在航空航天等领域应用广泛。下图是利用乙酰丙酸(CH3COCH2CH2COOH)合成聚芳酯E的路线(省略部分产物):
,在航空航天等领域应用广泛。下图是利用乙酰丙酸(CH3COCH2CH2COOH)合成聚芳酯E的路线(省略部分产物):
已知: 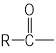 OH+SOCl2--→
OH+SOCl2--→ Cl+SO2 + HCl
Cl+SO2 + HCl
 Cl+R'OH→
Cl+R'OH→ OR'+HCl (R、R' 表示烃基)
OR'+HCl (R、R' 表示烃基)
(1)A中含有的官能团是_____________(填官能团名称)。
(2)A与CH3CH2OH反应生成B的反应类型为_____________________________。A的结构简式为________________________。
(3)写出B+D→E 的化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求,依靠理论知识做基础。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为:K=![]() ,它所对应的化学反应为:________________。
,它所对应的化学反应为:________________。
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)![]() CH3OH(g) △H=-90.8 kJ/mol
CH3OH(g) △H=-90.8 kJ/mol
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H=-23.5 kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5 kJ/mol
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.3 kJ/mol
CO2(g)+H2(g) △H=-41.3 kJ/mol
总反应:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g) 的△H =____________;二甲醚(CH3OCH3)直接作燃料电池具有启动快,效率高等优点,若电解质为酸性,该电池的负极反应为________________。
CH3OCH3(g)+CO2(g) 的△H =____________;二甲醚(CH3OCH3)直接作燃料电池具有启动快,效率高等优点,若电解质为酸性,该电池的负极反应为________________。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),该反应平衡常数随温度的变化如下表所示:
CO2(g)+H2(g),该反应平衡常数随温度的变化如下表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
该反应的正反应方向是_______反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为 0.020 mol/L,在该条件下,CO的平衡转化率为:________________。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如 NO、NO2、N2O4等,对反应N2O4(g)![]() 2NO2(g) △H >0,在温度为 T1、T2 时,平衡体系中 NO2的体积分数随压强变化曲线如图甲所示.下列说法正确的是________________。
2NO2(g) △H >0,在温度为 T1、T2 时,平衡体系中 NO2的体积分数随压强变化曲线如图甲所示.下列说法正确的是________________。
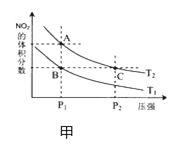
A. A、C 两点的反应速率:A>C
B. A、C 两点气体的颜色:A 深,C浅
C. B、C两点的气体的平均相对分子质量:B<C
D. 由状态 B 到状态 A,可以用加热的方法
E. A、C 两点的化学平衡常数:A>C
(5)NO2可用氨水吸收生成NH4NO3,25℃时,将m mol NH4NO3溶于水,溶液显酸性,向该溶液滴加 n L 氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将________(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为________mol/L(NH3·H2O的电离平衡常数取Kb=2×10﹣5 mol/L)。
(6)某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图乙所示,电极为多孔的材料能吸附气体,同时也能使气体与电解质溶液充分接触。
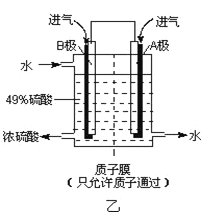
①溶液中H+的移动方向由________极到________极;(用 A、B 表示)
②B电极的电极反应式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com