
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,19g羟基(—18OH)中所含的中子数为9NA
B.常温下,1L pH=3的FeCl3溶液中由水电离出的H+的数目为0. 001 NA
C.标准状况下,NO和O2各11.2L 混合充分反应,所得气体的分子总数为0. 75 NA
D.足量的铜与40 mL10 mol/L硝酸反应,生成气体的分子数为0. 2 NA
【答案】B
【解析】
每个羟基 (—18OH)中所含的中子数为10; 2NO+O2=2NO2,2NO2![]() N2O4。
N2O4。
A.每个羟基 (—18OH)中所含的中子数为10+0=10,常温常压下,19g羟基(—18OH)物质的量为1mol,所以所含的中子数为10NA,A错误;
B.pH为3的FeCl3溶液中c(H+)=10-3mol/L,n(H+)=1L×10-3mol/L=0.001mol,由水电离产生的H+离子数目为0.001NA,B正确;
C.2NO+O2=2NO2,11.2L一氧化氮和11.2L氧气混合后生成二氧化氮11.2L同时氧气过量5.6L,气体分子总数为0. 75 NA,但二氧化氮与四氧化二氮存在平衡:2NO2![]() N2O4,所以混合气体分子总数小于0. 75 NA,C错误;
N2O4,所以混合气体分子总数小于0. 75 NA,C错误;
D.铜和40mL10mol/L硝酸反应,开始生成二氧化氮,后来生成NO,故生成的气体的分子个数无法计算,D错误。
答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某温度下,wg某物质在足量氧气中充分燃烧,其燃烧产物立即与过量的Na2O2反应,固体质量增加wg。在①H2;②CO;③CO和H2的混合物 ④甲醛(HCHO);⑤CH3COOH;⑥葡萄糖(C6H12O6)中,符合题意的是 ( )
A.均不符合B.只有①②③C.只有④⑤D.全部符合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】降冰片烯(结构见 F)的衍生物在橡胶工业有重要用途。一种利用脱羰偶联反应合成其衍生物的路线如下:
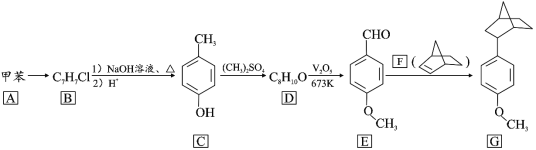
回答下列问题
(1)A→B 所需的试剂为_______________ 。
(2)B→C 第一步反应的化学方程式为_____。
(3)D 的结构简式为_____,C→D 的反应类型为_______。
(4)E 中的官能团名称为_____。
(5)芳香化合物X 是E 的同分异构体,X 能与热的NaOH 溶液反应生成稳定化合物, 0.1mol X 消耗 NaOH 0.2mol,化合物 X 共有_____种(不考虑立体异构)。其中核磁共振氢谱显示有 5 种不同化学环境的氢,峰面积比为 2∶2∶2∶1∶1 的结构简式为_____。
(6)参照上述路线,设计由苯甲醛、甲醇和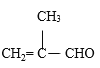 制备成
制备成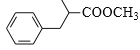 路线_____。(无机试剂任选)
路线_____。(无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼铁混合精矿含有硼镁石[MgBO2(OH)]、磁铁矿(Fe3O4) 、磁黄铁矿(Fe2S)、晶质铀矿(UO2)等,以该矿为原料制备MgSO4H2O和硼酸(H3BO3)的工艺流程如下:
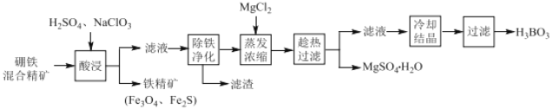
已知:UO22+在pH为4~5的溶液中生成UO2(OH)2沉淀。
回答下列问题:
(1)“酸浸”时,为了提高浸出率可采取的措施有:_______________________(至少答两个措施),该步骤中NaClO3可将UO2转化为UO22+,则该反应的离子方程式为 ________ 。
(2)“除铁净化”需要加入 ______ (填化学式)把溶液pH调节至4~5,滤渣的成分是____。
(3)“蒸发浓缩”时,加入固体MgCl2的作用是 ______________________ 。
(4)铁精矿(Fe3O4、Fe2S)经过一系列加工后,可用于制备氢氧化铁固体。已知T℃Ksp[Fe(OH)3]=4.0×10-39、Ksp[Fe(OH)2]=8.0×10-16 、Kw=10-a,回答下列问题:
①在T℃,假设Fe3+水解的离子方程式是:Fe3+(aq)+3H2O(l)= Fe(OH)3 (s)+3H+(aq),则该条件下Fe3+水解反应的平衡常数K=___________(用含a的字母表示)。
②在T℃向饱和的Fe(OH)3、Fe(OH)2混合溶液中,加入少量NaOH固体(忽略溶液体积变化),则溶液中的![]() 会________(填“变大”“变小”或“不变”),请结合相关数据推理说明:____________________________ 。
会________(填“变大”“变小”或“不变”),请结合相关数据推理说明:____________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.Na2O2遇到湿润的紫色石蕊试纸后,石蕊试纸最终变成蓝色
B.Na2O2晶体中阳离子和阴离子个数比为2:1
C.Na2O2与CO2反应生成0.1 mol O2时转移电子0.4 mol
D.向饱和烧碱溶液中加入2 g Na2O2,充分反应完后,溶液中c(Na+)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mLFeBr2溶液中通入标况下氯气6.72L,氯气全部被还原,测得溶液c(Br-)=c(Cl-),原溶液中FeBr2溶液的浓度( )(mol·L-1)
A.2B.4C.4.5D.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型高性能电池的开发与研究已成为当下信息产业化时代的迫切要求、某研究团队设计研制了种高性能的磷酸铁锂(LiFePO4,简称LFP)电池。正极材料为磷酸铁锂,与Al相连,负极材料为石墨,与Cu相连,正、负之间存在电解质并通过聚合物隔膜隔开,此膜只允许Li+通过,其工作原理如图所示,总反应为Li(1-x)C6十LiFePO4![]() LiC6+ Li(1-x) FePO4。下列有关说法正确的是
LiC6+ Li(1-x) FePO4。下列有关说法正确的是
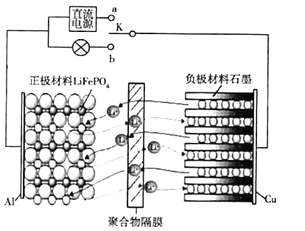
A.当开关K置于a时,Li+由右向左穿过聚合物隔膜到达正极
B.当开关K置于a时,正极材料上的电极反应为: Li(1-x) FePO4 +xLi ++xe- =LiFePO4
C.该电池的正、负极之间可以用Na2SO4水溶液作电解质溶液
D.当开关K置于b时,负极上的电极反应为:LiC6- xe- = Li(1-x) C6+xLi+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHC2O4溶液的pH < 7。常温下,向pH=8.4的Na2C2O4溶液中滴加0.1mol/L的HCl溶液,溶液pH与pOH[pOH=-lgc(OH-)]的变化关系如图所示,下列各点所示溶液中微粒的物质的量浓度关系一定正确的是

A. a点:c(H+)+c(HC2O4-)+2c(H2C2O4)=c(OH-)
B. b点:c(Cl-)>c(H2C2O4)+c(HC2O4-)+c(C2O42-)
C. c点:c(Na+)=c(HC2O4-)+ c(C2O42-)+c(Cl-)
D. d点:c(OH-)+ c(Cl-)>c(H+)+2c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定的条件下,下列选项所示的物质间转化均能实现的是( )
A.Na ![]() Na2O
Na2O![]() NaOH
NaOH
B.MgCO3![]() MgCl2
MgCl2![]() Mg
Mg
C.Al2O3![]() Al
Al![]() Fe
Fe
D.Fe2O3![]() FeCl3
FeCl3![]() FeCl2(aq)
FeCl2(aq)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com