
【题目】硼铁混合精矿含有硼镁石[MgBO2(OH)]、磁铁矿(Fe3O4) 、磁黄铁矿(Fe2S)、晶质铀矿(UO2)等,以该矿为原料制备MgSO4H2O和硼酸(H3BO3)的工艺流程如下:
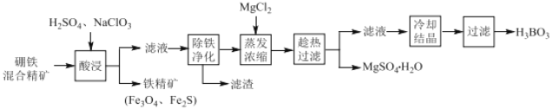
已知:UO22+在pH为4~5的溶液中生成UO2(OH)2沉淀。
回答下列问题:
(1)“酸浸”时,为了提高浸出率可采取的措施有:_______________________(至少答两个措施),该步骤中NaClO3可将UO2转化为UO22+,则该反应的离子方程式为 ________ 。
(2)“除铁净化”需要加入 ______ (填化学式)把溶液pH调节至4~5,滤渣的成分是____。
(3)“蒸发浓缩”时,加入固体MgCl2的作用是 ______________________ 。
(4)铁精矿(Fe3O4、Fe2S)经过一系列加工后,可用于制备氢氧化铁固体。已知T℃Ksp[Fe(OH)3]=4.0×10-39、Ksp[Fe(OH)2]=8.0×10-16 、Kw=10-a,回答下列问题:
①在T℃,假设Fe3+水解的离子方程式是:Fe3+(aq)+3H2O(l)= Fe(OH)3 (s)+3H+(aq),则该条件下Fe3+水解反应的平衡常数K=___________(用含a的字母表示)。
②在T℃向饱和的Fe(OH)3、Fe(OH)2混合溶液中,加入少量NaOH固体(忽略溶液体积变化),则溶液中的![]() 会________(填“变大”“变小”或“不变”),请结合相关数据推理说明:____________________________ 。
会________(填“变大”“变小”或“不变”),请结合相关数据推理说明:____________________________ 。
【答案】将硼铁矿粉碎、适当提高硫酸的浓度、搅拌、升高温度等 3UO2+6H+ +C1O3—= 3UO22-+ +3H2O+C1— MgO Fe(OH)3、UO2(OH)2 增大 Mg2+ 浓度,有利于MgSO4·H2O析出 2.5×10(37—3a) 变大 ![]() =
=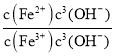 =
=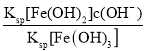 =
=![]() =2.0×1022×c(OH-),加入NaOH固体后,溶液的c(OH—)增大,所以
=2.0×1022×c(OH-),加入NaOH固体后,溶液的c(OH—)增大,所以![]() 变大
变大
【解析】
硼铁混合精矿含有硼镁石[MgBO2(OH)]、磁铁矿(Fe3O4)、磁黄铁矿(Fe2S)、晶质铀矿(UO2)等,加入硫酸、NaClO3,NaClO3可将UO2转化为UO22+,过滤除去少量铁精矿(Fe3O4、Fe2S),调节滤液的pH除铁净化,可生成氢氧化铁、UO2(OH)2沉淀,过滤后的溶液中加入氯化镁,进行蒸发浓缩,趁热过滤可得到硫酸镁晶体,滤液中含有硼酸,冷却结晶得到硼酸(H3BO3)晶体,据此分析解答。
(1)酸浸”时,为了提高浸出率可采取的措施有:搅拌、升高温度、延长浸出时间、适当提高硫酸的浓度,将硼铁矿粉碎等;NaClO3可将UO2转化为UO22+,反应的离子方程式为3UO2+6H++ClO3-=3UO22++3H2O+Cl-,故答案为:将硼铁矿粉碎、适当提高硫酸的浓度、搅拌、升高温度等;3UO2+6H++ClO3-=3UO22++3H2O+Cl-;
(2)除铁净化时,调节pH,需要避免引入新杂质,可加入MgO或Mg(OH)2等,生成的沉淀为Fe(OH)3、UO2(OH)2,故答案为:MgO或Mg(OH)2;Fe(OH)3、UO2(OH)2;
(3)“蒸发浓缩”时,加入固体MgCl2,可使溶液中镁离子浓度增大,有利于析出MgSO4H2O,故答案为:增大镁离子浓度,有利于析出MgSO4H2O;
(4)①在T℃,Fe3+水解方程式为Fe3+(aq)+3H2O(l)═Fe(OH)3(s)+3H+(aq),则该条件下Fe3+水解反应的平衡常数K=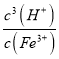 =
=![]() =
=![]() =2.5×10(37-3a),故答案为:2.5×10(37-3a);
=2.5×10(37-3a),故答案为:2.5×10(37-3a);
②![]() =
=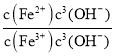 =
=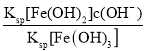 =
=![]() =2.0×1022×c(OH-),在T℃向饱和Fe(OH)3、Fe(OH)2的混合溶液中,加入少量NaOH固体,溶液中的c(OH-)增大,则
=2.0×1022×c(OH-),在T℃向饱和Fe(OH)3、Fe(OH)2的混合溶液中,加入少量NaOH固体,溶液中的c(OH-)增大,则![]() 变大,故答案为:变大;
变大,故答案为:变大;![]() =
=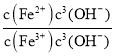 =
=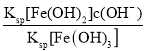 =
=![]() =2.0×1022×c(OH-),加入少量NaOH固体,溶液中的c(OH-)增大,则
=2.0×1022×c(OH-),加入少量NaOH固体,溶液中的c(OH-)增大,则![]() 变大。
变大。


科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.向氨水中通入过量SO2:NH3·H2O+SO2=NH4++HSO3-
B.Si与NaOH溶液反应:Si+2OH-+H2O=SiO32-+H2↑
C.向NH4HCO3溶液中加入过量NaOH溶液并加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
D.Ba(OH)2溶液中滴入NaHSO4溶液至Ba2+恰好完全沉淀:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如下图所示,试回答:

(1)a点之前的反应的离子方程式为________________。
(2)a点到b点之间的反应的离子方程式是________________、________________。
(3)c点二氧化碳体积是________L。
(4)混合稀溶液中Ba(OH)2和NaOH的物质的量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积恒定的密闭容器中,一定量的二氧化硫与1.100mol氧气在催化剂作用下加热到600℃发生反应:2SO2+O2![]() 2SO3。当气体的物质的量减少0.315mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是( )
2SO3。当气体的物质的量减少0.315mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是( )
A. 三氧化硫生成的速率与二氧化硫消耗的速率相等时反应达到平衡
B. 降低温度,正反应速率减小,逆反应速率增大
C. 平衡混合气体通入过量氯化钡溶液中,得到沉淀的质量为161.980g
D. 达到平衡时,二氧化硫的转化率为90%
查看答案和解析>>
科目:高中化学 来源: 题型:
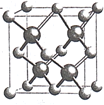
【题目】最近一期《物理评论快报》报道了科学家成功制备了包含钙(Ca)、钾(K)、铁(Fe)和砷(As)以及少量镍(Ni)的新型化合物材料[CaK(Fe1-x一Nix)4As4).回答下列问题:
(1)基态镍原子的价层电子排布式为________,基态砷原子最高能级的电子云有________个伸展方向.
(2)亚铁氰化钾{K4[Fe(CN)6]}是食盐中广泛使用的抗结剂,化学式中涉及的所有元素的笫一电离能由小到大的顺序为________,[Fe(CN)6]4-中,铁提供的空轨道数目为________,气态化合物X与CN一互为等电子体,则X的化学式为________.
(3)AsCl3分子中砷的杂化类型为________;其空间构型为________。
(4)已知:CaO、K2S的熔点分别为2572℃、840℃,二者熔点差异的主要原因是________。
(5)镍和硫形成的某晶体.其晶胞如图所示.巳知该晶体密度为dgcm-3,NA为阿伏加德罗常数的值。则Ni、S原子最短核间距(D)为________________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3、NO2、SO2处理不当易造成环境污染,如果对这些气体加以利用就可以变废为宝,既减少了对环境的污染,又解决了部分能源危机问题。
(1)硝酸厂常用催化还原方法处理尾气。CH4在催化条件下可以NO2将还原为N2。已知:
CH4 (g)+2O2(g)=CO2(g)+2H2O(l) △H1=-890.3kJmol-1 ①
N2 (g) +2O2(g)=2 NO2 (g) △H2=+67.7kJmol-1 ②
则反应CH4 (g)+2NO2(g)=CO2(g)+ N2 (g)+ 2H2O(l) △H= _____________ 。
(2)工业上利用氨气生产氢氰酸(HCN)的反应为:CH4 (g)+ NH3 (g) ![]() HCN(g)+ 3H2 (g) △H>0
HCN(g)+ 3H2 (g) △H>0
①在一定温度条件下,向2L恒容密闭容器中加入2mol CH4和2mol NH3,平衡时NH3 体积分数为30%,所用时间为10min,则该时间段内用CH4的浓度变化表示的反应速率为__________________molL-1min-1 ,该温度下平衡常数K=_________。若保持温度不变,再向容器中加入CH4 和H2各1mol,则此时v正= ________ (填“>”“=”或“<”)v逆。
②其他条件一定,达到平衡时NH3 转化率随外界条件X 变化的关系如图1所示,X 代表 __________(填字母代号)
A.温度 B. 压强 C. 原料中CH4与NH3的体积比
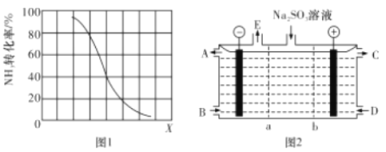
(3)某研究小组用NaOH 溶液吸收尾气中的二氧化碳,将得到的Na2SO3进行电解生产硫酸,其中阴、阳膜组合电解装置如图2所示,电极材料为石墨,A~E分别代表生产中的原料或产品,b表示_____(填“阴”或“阳”)离子交换膜,阳极的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,19g羟基(—18OH)中所含的中子数为9NA
B.常温下,1L pH=3的FeCl3溶液中由水电离出的H+的数目为0. 001 NA
C.标准状况下,NO和O2各11.2L 混合充分反应,所得气体的分子总数为0. 75 NA
D.足量的铜与40 mL10 mol/L硝酸反应,生成气体的分子数为0. 2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
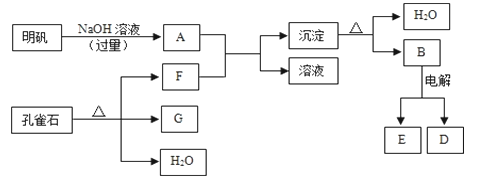
【题目】在一定条件下可实现下图所示物质之间的转化:
请填写下列空白:
(1)孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜),受热易分解,图中的F是______(填化学式)。
(2)写出明矾溶液与过量NaOH溶液反应的离子方程式:_________________。
(3)图中所得G和D都为固体,混合后在高温下可发生反应,写出该反应的化学方程式_______,该反应消耗了3 molG,则转移的电子数是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 表示为阿伏加德罗常数,下列叙述中,正确的是( )
A.常温常压下,16 g O2和O3的混合物中共含有NA个氧原子
B.假设1 mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NA
C.78 g Na2O2 固体中所含阴、阳离子总数为4NA
D.在铜与硫有反应中,1 mol铜原子参加反应失去的电子数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com