
【题目】NH3、NO2、SO2处理不当易造成环境污染,如果对这些气体加以利用就可以变废为宝,既减少了对环境的污染,又解决了部分能源危机问题。
(1)硝酸厂常用催化还原方法处理尾气。CH4在催化条件下可以NO2将还原为N2。已知:
CH4 (g)+2O2(g)=CO2(g)+2H2O(l) △H1=-890.3kJmol-1 ①
N2 (g) +2O2(g)=2 NO2 (g) △H2=+67.7kJmol-1 ②
则反应CH4 (g)+2NO2(g)=CO2(g)+ N2 (g)+ 2H2O(l) △H= _____________ 。
(2)工业上利用氨气生产氢氰酸(HCN)的反应为:CH4 (g)+ NH3 (g) ![]() HCN(g)+ 3H2 (g) △H>0
HCN(g)+ 3H2 (g) △H>0
①在一定温度条件下,向2L恒容密闭容器中加入2mol CH4和2mol NH3,平衡时NH3 体积分数为30%,所用时间为10min,则该时间段内用CH4的浓度变化表示的反应速率为__________________molL-1min-1 ,该温度下平衡常数K=_________。若保持温度不变,再向容器中加入CH4 和H2各1mol,则此时v正= ________ (填“>”“=”或“<”)v逆。
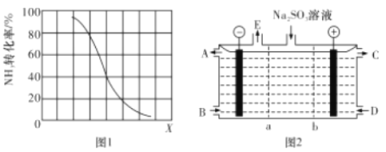
②其他条件一定,达到平衡时NH3 转化率随外界条件X 变化的关系如图1所示,X 代表 __________(填字母代号)
A.温度 B. 压强 C. 原料中CH4与NH3的体积比
(3)某研究小组用NaOH 溶液吸收尾气中的二氧化碳,将得到的Na2SO3进行电解生产硫酸,其中阴、阳膜组合电解装置如图2所示,电极材料为石墨,A~E分别代表生产中的原料或产品,b表示_____(填“阴”或“阳”)离子交换膜,阳极的电极反应式为________。
【答案】—958.0kJmo1—1 0.025 ![]() 或0.1875(mo1/L)2 < B 阴 SO32——2e— +H2O= 2H+ +SO42—
或0.1875(mo1/L)2 < B 阴 SO32——2e— +H2O= 2H+ +SO42—
【解析】
(1) 根据盖斯定律分析计算;
(2)①根据三段式结合平衡时NH3体积分数为30%计算出反应的氨气的物质的量,再结合v(CH4) =![]() =
=![]() 和K=
和K=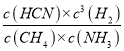 计算,保持温度不变,再向容器中加入CH4和H2各1 mol,根据Qc与K的关系判断平衡移动的方向;②根据图示,X越大,转化率越小,平衡逆向移动,结合影响平衡移动的因素分析判断;
计算,保持温度不变,再向容器中加入CH4和H2各1 mol,根据Qc与K的关系判断平衡移动的方向;②根据图示,X越大,转化率越小,平衡逆向移动,结合影响平衡移动的因素分析判断;
(3)由得到的Na2SO3进行电解生产硫酸,硫酸根来源于亚硫酸根的放电,该过程发生氧化反应,在阳极发生,据此分析解答。
(1)CH4(g)+2O2(g)═CO2(g)+2H2O(g) △H=-890.3kJmol-1①,N2(g)+2O2(g)═2NO2(g) △H=+67.7kJmol-1②,根据盖斯定律,将①-②可得热化学方程式:CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g) △H=(-890.3kJmol-1)-(+67.7kJmol-1)=-958.0kJmol-1,故答案为:-958.0kJmol-1;
(2)①设10 min时,反应的氨气的物质的量为x(mol),
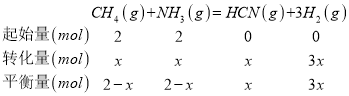
则![]() ×100%=30%,解得:x=0.5,v(CH4)=
×100%=30%,解得:x=0.5,v(CH4)=![]() =
=![]() =
=![]() =0.025mol/(Lmin);该温度下,平衡常数K=
=0.025mol/(Lmin);该温度下,平衡常数K=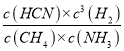 =
=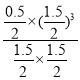 =0.1875(mol/L)2;保持温度不变,再向容器中加入CH4和H2各1 mol,此时Qc=
=0.1875(mol/L)2;保持温度不变,再向容器中加入CH4和H2各1 mol,此时Qc=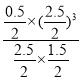 ═0.5208(mol/L)2>K,平衡逆向移动,则v正<v逆,故答案为:0.025;0.1875(mol/L)2;<;
═0.5208(mol/L)2>K,平衡逆向移动,则v正<v逆,故答案为:0.025;0.1875(mol/L)2;<;
②根据图示,X越大,NH3转化率越小,平衡逆向移动。A、该反应为吸热反应,温度升高,平衡正向移动,NH3转化率增大,故A错误;B、该反应为气体物质的量增大的反应,增大压强,平衡逆向移动,NH3转化率减小,故B正确;C、原料中CH4的体积越大,平衡正向进行程度越高,氨气的转化率越高,故C错误;故答案为:B;
(3)Na2SO3进行电解生产硫酸,硫酸根来源于亚硫酸根的放电,该过程为氧化反应,在阳极上发生,故b为阴离子交换膜,阳极的电极反应式为SO32--2e-+H2O=2H++SO42-,故答案为:阴;SO32--2e-+H2O=2H++SO42-。


科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 实验结论 |
A | SO2缓慢通入滴有酚酞的NaOH溶液中,溶液红色褪去 | SO2具有漂白性 |
B | 将充满NO2的密闭玻璃球浸泡在热水中,气体红棕色加深 | 2NO2(g) |
C | 将稀硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 氧化性:H2O2>Fe3+ |
D | 向2支均盛有2mL相同浓度Na3[Ag(S2O3)2]溶液的试管中,分别滴入2滴相同浓度的KCl、KI溶液,前者无明显现象,后者有黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
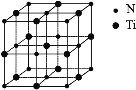
【题目】钛金属重量轻、强度高、有良好的抗腐蚀能力,其单质及其化合物在航空航天、武器装备、能源、化工、冶金、建筑和交通等领域应用前景广阔。回答下列问题:
(1)三氟化钛可用于制取钛氟玻璃,基态 F 原子核外有_____个未成对电子,Ti 原子形成Ti3+时价层电子层排布式为_____。
(2)TiO2 的熔点为 1800℃,TiCl4 的熔点为-25℃,则 TiO2 的晶体类型为_____,TiCl4 熔点低的原因为_____。
(3)钛某配合物可用于催化环烯烃聚合,其结如图所示:
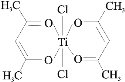
①钛的配位数为_____,该化合物中电负性最大元素是_____(填元素符号)。
②该配合物中不含有的化学键有_____(填字母标号)。
a.离子键 b.σ键 c.金属键 d.π键
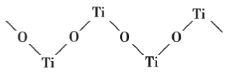
(4)已知 TiO2 与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子化学式为_____,阳离子中 O 的杂化方式为_____,阴离子的空间构型为_____。
(5)氮化钛可以用于制作电池的材料,其晶胞如图,该晶胞的密度为ρ g·cm-3,与氮原子最近的且距离相等的钛原子有_____个,氮原子与钛原子最近的距离为_____cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯( )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知:![]() (g)=
(g)= ![]() (g)+H2(g) ΔH1=100.3 kJ·mol 1 ①
(g)+H2(g) ΔH1=100.3 kJ·mol 1 ①
H2(g)+ I2(g)=2HI(g) ΔH2=﹣11.0 kJ·mol 1 ②
对于反应:![]() (g)+ I2(g)=
(g)+ I2(g)=![]() (g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(2)某温度下,等物质的量的碘和环戊烯(![]() )在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________,该反应的平衡常数Kp=_________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有__________(填标号)。
)在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________,该反应的平衡常数Kp=_________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有__________(填标号)。
A.通入惰性气体 B.提高温度
C.增加环戊烯浓度 D.增加碘浓度
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是__________(填标号)。

A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L1
(4)环戊二烯可用于制备二茂铁(Fe(C5H5)2结构简式为 ),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。

该电解池的阳极为____________,总反应为__________________。电解制备需要在无水条件下进行,原因为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼铁混合精矿含有硼镁石[MgBO2(OH)]、磁铁矿(Fe3O4) 、磁黄铁矿(Fe2S)、晶质铀矿(UO2)等,以该矿为原料制备MgSO4H2O和硼酸(H3BO3)的工艺流程如下:
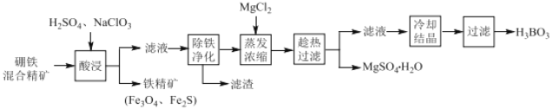
已知:UO22+在pH为4~5的溶液中生成UO2(OH)2沉淀。
回答下列问题:
(1)“酸浸”时,为了提高浸出率可采取的措施有:_______________________(至少答两个措施),该步骤中NaClO3可将UO2转化为UO22+,则该反应的离子方程式为 ________ 。
(2)“除铁净化”需要加入 ______ (填化学式)把溶液pH调节至4~5,滤渣的成分是____。
(3)“蒸发浓缩”时,加入固体MgCl2的作用是 ______________________ 。
(4)铁精矿(Fe3O4、Fe2S)经过一系列加工后,可用于制备氢氧化铁固体。已知T℃Ksp[Fe(OH)3]=4.0×10-39、Ksp[Fe(OH)2]=8.0×10-16 、Kw=10-a,回答下列问题:
①在T℃,假设Fe3+水解的离子方程式是:Fe3+(aq)+3H2O(l)= Fe(OH)3 (s)+3H+(aq),则该条件下Fe3+水解反应的平衡常数K=___________(用含a的字母表示)。
②在T℃向饱和的Fe(OH)3、Fe(OH)2混合溶液中,加入少量NaOH固体(忽略溶液体积变化),则溶液中的![]() 会________(填“变大”“变小”或“不变”),请结合相关数据推理说明:____________________________ 。
会________(填“变大”“变小”或“不变”),请结合相关数据推理说明:____________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅的单质、氧化物、盐在现代工业中有着重要用途。
I.(1)铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化的PbO2、还有组成类似Fe3O4的Pb3O4 ,请将Pb3O4 改写成简单氧化物的形式: _________。
II.以废旧铅酸电池中的含铅废料铅膏(Pb、PbO 、PbO2、PbSO4等)为原料,制备超细PbO ,实现铅的再生利用。其工作流程如下:
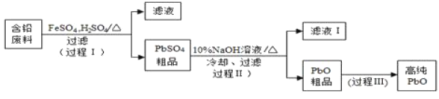

(2)步骤① 的目的是“脱硫”,即将PbSO4转化PbSO3,反应的离子方程式为_______________________。
“脱硫过程”可在如图所示的装置中进行,实验条件为:转化温度为35℃,液固比为5:1,转化时间为2h.。
①仪器a的名称是 __________;转化温度为35 ℃, 采用的合适加热方式是________。
②步骤②中H2O2的作用是 __________________ (用化学方程式表示)。
(3)草酸铅受热分解生成PbO时,还有CO和CO2生成,为检验这两种气体,用下图所示装置(可重复选用)进行实验。实验装置中,依次连接的合理顺序为A _____________(填装置字母代号),证明产物中有CO气体的实验现象是________________。

(4)测定草酸铅样品纯度:称取2.5g样品,酸溶后配制成250mL溶液,然后量取25.00mL该溶液,用0.05000molL-1的EDTA(Na2H2Y)标准溶液滴定其中的Pb2+ (反应方程式为Pb2++H2Y2-= PbY2- +2H+,杂质不反应),平行滴定三次,平均消耗EDTA标准溶液14.52mL
①若滴定管未用 EDT A 标准液润洗,测定结果将_________ (填“偏高” “偏低” 或“不变”)。
②草酸铅的纯度为 __________(保留四位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mLFeBr2溶液中通入标况下氯气6.72L,氯气全部被还原,测得溶液c(Br-)=c(Cl-),原溶液中FeBr2溶液的浓度( )(mol·L-1)
A.2B.4C.4.5D.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某学生用0.1 mol·L-1H2SO4溶液滴定0.1 mol·L-1NaOH溶液,中和后加水至100 mL。若滴定终点的判定有误差:①少滴了一滴H2SO4溶液;②多滴了一滴H2SO4溶液(1滴为0.05 mL),则①和②两种情况下所得溶液的pH之差是( )
A. 4B. 4.6C. 5.4D. 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置由甲、乙两部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)2NH2]氧化为环境友好物质形成的化学电源。当电池工作时,下列说法错误的是( )
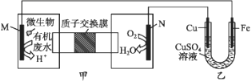
A. 甲中H+透过质子交换膜由左向右移动
B. M极电极反应式:H2N(CH2)2NH2+4H2O-16e-![]() 2CO2↑+N2↑+16H+
2CO2↑+N2↑+16H+
C. 一段时间后,乙中CuSO4溶液浓度基本保持不变
D. 当N极消耗0.25 mol O2时,则铁极增重16 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com