
【题目】最近一期《物理评论快报》报道了科学家成功制备了包含钙(Ca)、钾(K)、铁(Fe)和砷(As)以及少量镍(Ni)的新型化合物材料[CaK(Fe1-x一Nix)4As4).回答下列问题:
(1)基态镍原子的价层电子排布式为________,基态砷原子最高能级的电子云有________个伸展方向.
(2)亚铁氰化钾{K4[Fe(CN)6]}是食盐中广泛使用的抗结剂,化学式中涉及的所有元素的笫一电离能由小到大的顺序为________,[Fe(CN)6]4-中,铁提供的空轨道数目为________,气态化合物X与CN一互为等电子体,则X的化学式为________.
(3)AsCl3分子中砷的杂化类型为________;其空间构型为________。
(4)已知:CaO、K2S的熔点分别为2572℃、840℃,二者熔点差异的主要原因是________。
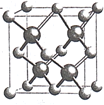
(5)镍和硫形成的某晶体.其晶胞如图所示.巳知该晶体密度为dgcm-3,NA为阿伏加德罗常数的值。则Ni、S原子最短核间距(D)为________________cm。
【答案】3d84s2 3 K<Fe<C<N 6 CO(或其他合理答案) sp3 三角锥形 CaO、K2S都是离子晶体.Ca2+所带电荷数大于K+且Ca2+的半径小于K+.O2-的半径小于S2-,故CaO的晶格能大于K2S.所以熔点CaO>K2S 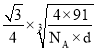
【解析】
(1)依据镍元素的原子序数为28,确定基态镍原子的核外电子排布式;依据砷元素的原子序数为33,其价电子排布式,确定基态砷原子最高能级,然后确定在确定最高能级的伸展方向;
(2)根据元素在周期表的位置特征,判断元素的第一电离能;
(3)根据价层电子对数确定中心原子的杂化类型,结合价层电子对数和孤电子对数确定分子的空间构型;
(4)离子晶体晶格能越大晶体的熔点越高,找出影响晶格能大小的因素;
(5)利用均摊法计算出1个晶胞中含有Ni、S的原子个数,结合密度和阿伏加德罗常数,计算出晶胞的棱长。
(1)镍元素的原子序数为28,基态镍原子的价层电子排布式为3d84s2;砷元素的原子序数为33,属于第四周期第ⅤA族,基态砷原子的核外电子排布式为[Ar]3d104s24p3,最高能级为4p,其电子云有3个伸展方向;
(2)一般金属性越强第一电离能越小,同周期主族元素随原子序数的增大第一电离能呈增大趋势,第ⅡA族、第ⅤA族元素的第一电离能大于同周期相邻元素的第一电离能,故第一电离能由小到大的顺序为 K<Fe<C<N;Fe2+与CN-形成6个配位键,[Fe(CN)6]4-中铁提供的空轨道数目为6;原子个数相同,价电子数相等的几种不同的分子互为等电子体,故与CN-互为等电子体的气体分子为N2或CO;
(3)1个AsCl3分子中含有3个![]() 键,中心原子As含有一对孤电子对,价层电子对数为4,故AsCl3分子中砷的杂化类型为sp3;其空间构型为三角锥形。
键,中心原子As含有一对孤电子对,价层电子对数为4,故AsCl3分子中砷的杂化类型为sp3;其空间构型为三角锥形。
(4)离子晶体熔沸点的高低与晶格能的大小有关,离子晶体的晶格能越大,离子晶体的熔沸点越高。离子所带电荷数越多、离子半径越小,晶格能越大。Ca2+所带电荷数比K+所带电荷数多,且Ca2+半径比K+半径小,所以晶格能CaOK2S,熔点CaOK2S;
(5)晶胞顶点原子与四面体中心原子距离最近,二者连线处于体对角线上,可知二者最短距离为体对角线长度的![]() ,晶胞的体对角线的长度是晶胞棱长的
,晶胞的体对角线的长度是晶胞棱长的![]() 倍,由NiS的晶胞图可知,一种原子有8个在顶点,6个在面心,该原子的个数为
倍,由NiS的晶胞图可知,一种原子有8个在顶点,6个在面心,该原子的个数为![]() =4,另一种原子有4个在体心,故一个NiS的晶胞中含有4个Ni原子和4个S原子,令晶胞的棱长为acm,则a3×d×NA=4×(59+32)=4×91,a=
=4,另一种原子有4个在体心,故一个NiS的晶胞中含有4个Ni原子和4个S原子,令晶胞的棱长为acm,则a3×d×NA=4×(59+32)=4×91,a=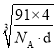 ,Ni、S原子最短核间距(D)为
,Ni、S原子最短核间距(D)为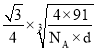 cm。
cm。


科目:高中化学 来源: 题型:
【题目】Ⅰ.我国的青海省有许多盐湖盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用。粗盐中含Ca2+、Mg2+、SO42-以及泥沙等杂质,为了除去可溶性杂质,有以下实验步骤进行提纯:
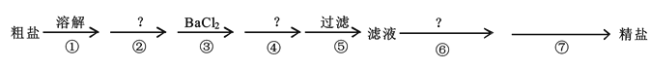
(1)④步所加试剂是____。
(2)第⑥步发生反应的离子方程式为____、____。
(3)第⑦步的操作名称____,需要的玻璃仪器有____、____。
(4)通过步骤⑤中过滤后的滤液,检验SO42-已除尽的操作方法是____。
Ⅱ.(1)设阿伏加德罗常数为NA,标准状况下,某O2和N2的混合气体m g含有b个分子,则n g该混合气体在相同状况下所占的体积是____L。
(2)在xR2++yH++O2═mR3++nH2O的离子方程式中,对化学计量数m和R2+、R3+判断正确的是____。
A.m=y,R3+是氧化产物 B.m=2y,R2+被氧化
C.m=2,R3+是氧化剂 D.m=4,R2+是还原剂
(3)用双线桥法标出下列反应的电子转移方向和数目____。2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是一些烷烃的燃烧热,则下列表达正确的是
化合物 | 燃烧热/ kJ·mol-1 | 化合物 | 燃烧热/ kJ·mol-1 |
甲烷 | 891.0 | 正丁烷 | 2878.0 |
乙烷 | 1560.8 | 异丁烷 | 2869.6 |
丙烷 | 2221.5 | 异戊烷 | 3531.3 |
A. 正戊烷的燃烧热大于3531.3 kJ·mol-1
B. 相同质量的烷烃、碳的质量分数越大,燃烧放出的热量越多
C. 正丁烷转化为异丁烷的热化学方程式为:CH3CH2CH2CH3(g) ![]() CH3CH(CH3)CH3(g) △H =+8.4kJ·mol-1
CH3CH(CH3)CH3(g) △H =+8.4kJ·mol-1
D. 甲烷燃烧的热化学方程式为:CH4(g)+2O2(g) ![]() CO2(g) +2H2O(g) △H =-891.0kJ·mol-1
CO2(g) +2H2O(g) △H =-891.0kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】降冰片烯(结构见 F)的衍生物在橡胶工业有重要用途。一种利用脱羰偶联反应合成其衍生物的路线如下:
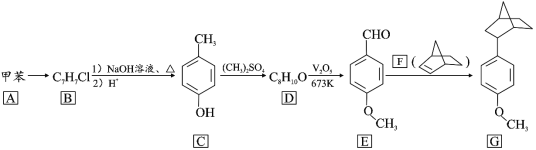
回答下列问题
(1)A→B 所需的试剂为_______________ 。
(2)B→C 第一步反应的化学方程式为_____。
(3)D 的结构简式为_____,C→D 的反应类型为_______。
(4)E 中的官能团名称为_____。
(5)芳香化合物X 是E 的同分异构体,X 能与热的NaOH 溶液反应生成稳定化合物, 0.1mol X 消耗 NaOH 0.2mol,化合物 X 共有_____种(不考虑立体异构)。其中核磁共振氢谱显示有 5 种不同化学环境的氢,峰面积比为 2∶2∶2∶1∶1 的结构简式为_____。
(6)参照上述路线,设计由苯甲醛、甲醇和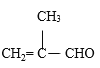 制备成
制备成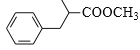 路线_____。(无机试剂任选)
路线_____。(无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.lmolL-1的盐酸滴定10.0mL0.lmolL-1Na2A溶液,所得滴定曲线如图所示.下列说法正确的是
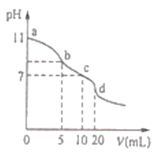
A.常温下,A2-的水解常数Khl(A2-)的数量级为10-6
B.b点溶液中:c(HA-)+2c(H2A)+c(H+)=c(Cl-)+c(OH-)
C.c点溶液中:c(HA-)+c(A2-)+c(H2A)=0.lmolL-1
D.d点溶液中:c(A2-)+c(HA-)=c((H+)<c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼铁混合精矿含有硼镁石[MgBO2(OH)]、磁铁矿(Fe3O4) 、磁黄铁矿(Fe2S)、晶质铀矿(UO2)等,以该矿为原料制备MgSO4H2O和硼酸(H3BO3)的工艺流程如下:
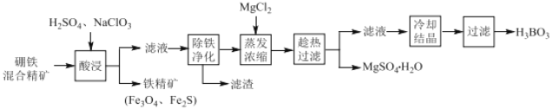
已知:UO22+在pH为4~5的溶液中生成UO2(OH)2沉淀。
回答下列问题:
(1)“酸浸”时,为了提高浸出率可采取的措施有:_______________________(至少答两个措施),该步骤中NaClO3可将UO2转化为UO22+,则该反应的离子方程式为 ________ 。
(2)“除铁净化”需要加入 ______ (填化学式)把溶液pH调节至4~5,滤渣的成分是____。
(3)“蒸发浓缩”时,加入固体MgCl2的作用是 ______________________ 。
(4)铁精矿(Fe3O4、Fe2S)经过一系列加工后,可用于制备氢氧化铁固体。已知T℃Ksp[Fe(OH)3]=4.0×10-39、Ksp[Fe(OH)2]=8.0×10-16 、Kw=10-a,回答下列问题:
①在T℃,假设Fe3+水解的离子方程式是:Fe3+(aq)+3H2O(l)= Fe(OH)3 (s)+3H+(aq),则该条件下Fe3+水解反应的平衡常数K=___________(用含a的字母表示)。
②在T℃向饱和的Fe(OH)3、Fe(OH)2混合溶液中,加入少量NaOH固体(忽略溶液体积变化),则溶液中的![]() 会________(填“变大”“变小”或“不变”),请结合相关数据推理说明:____________________________ 。
会________(填“变大”“变小”或“不变”),请结合相关数据推理说明:____________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.Na2O2遇到湿润的紫色石蕊试纸后,石蕊试纸最终变成蓝色
B.Na2O2晶体中阳离子和阴离子个数比为2:1
C.Na2O2与CO2反应生成0.1 mol O2时转移电子0.4 mol
D.向饱和烧碱溶液中加入2 g Na2O2,充分反应完后,溶液中c(Na+)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型高性能电池的开发与研究已成为当下信息产业化时代的迫切要求、某研究团队设计研制了种高性能的磷酸铁锂(LiFePO4,简称LFP)电池。正极材料为磷酸铁锂,与Al相连,负极材料为石墨,与Cu相连,正、负之间存在电解质并通过聚合物隔膜隔开,此膜只允许Li+通过,其工作原理如图所示,总反应为Li(1-x)C6十LiFePO4![]() LiC6+ Li(1-x) FePO4。下列有关说法正确的是
LiC6+ Li(1-x) FePO4。下列有关说法正确的是
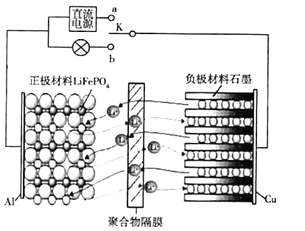
A.当开关K置于a时,Li+由右向左穿过聚合物隔膜到达正极
B.当开关K置于a时,正极材料上的电极反应为: Li(1-x) FePO4 +xLi ++xe- =LiFePO4
C.该电池的正、负极之间可以用Na2SO4水溶液作电解质溶液
D.当开关K置于b时,负极上的电极反应为:LiC6- xe- = Li(1-x) C6+xLi+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】福酚美克是一种影响机体免疫力功能的药物,可通过以下方法合成:
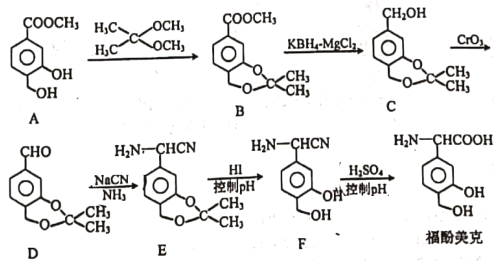
(1)B中的含氧官能团有________和_________(填名称);
(2)C→D的转化属于_________反应(填反应类型).
(3)已知E→F的转化属于取代反应,则反应中另—产物的结构简式为______。
(4) A (C9H10O4)的一种同分异构体X满足下列条件:
I.X分子有中4种不同化学环境的氢。
II. X能与FeCl3溶液发生显色反应。
III. lmol X最多能与4 mol NaOH发生反应
写出该同分异构体的结构简式:_____________。
(5)已知:![]()
![]()
![]() +R3CHO,根据已有知识并结合相关信息.
+R3CHO,根据已有知识并结合相关信息.
写出以  为原料制备
为原料制备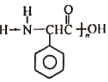 的合成路线流程图(无机试剂任用)。____________
的合成路线流程图(无机试剂任用)。____________
合成路线流程图示例如下:CH3CH2Br![]() CH3CH2OH
CH3CH2OH ![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com