
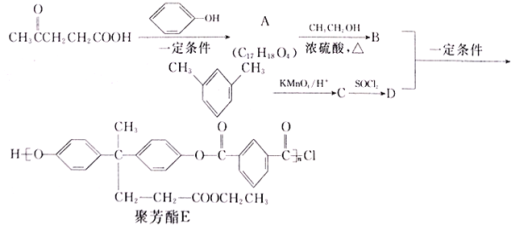
【题目】随着我国航天事业的飞速发展,对材料的需求也越来越多,聚芳酯(PAR)是分子主链上带来苯环和酯基的特种工程塑料,其结构简式为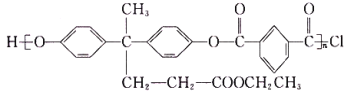 ,在航空航天等领域应用广泛。下图是利用乙酰丙酸(CH3COCH2CH2COOH)合成聚芳酯E的路线(省略部分产物):
,在航空航天等领域应用广泛。下图是利用乙酰丙酸(CH3COCH2CH2COOH)合成聚芳酯E的路线(省略部分产物):
已知: 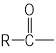 OH+SOCl2--→
OH+SOCl2--→ Cl+SO2 + HCl
Cl+SO2 + HCl
 Cl+R'OH→
Cl+R'OH→ OR'+HCl (R、R' 表示烃基)
OR'+HCl (R、R' 表示烃基)
(1)A中含有的官能团是_____________(填官能团名称)。
(2)A与CH3CH2OH反应生成B的反应类型为_____________________________。A的结构简式为________________________。
(3)写出B+D→E 的化学方程式为__________________________。
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】下表是一些烷烃的燃烧热,则下列表达正确的是
化合物 | 燃烧热/ kJ·mol-1 | 化合物 | 燃烧热/ kJ·mol-1 |
甲烷 | 891.0 | 正丁烷 | 2878.0 |
乙烷 | 1560.8 | 异丁烷 | 2869.6 |
丙烷 | 2221.5 | 异戊烷 | 3531.3 |
A. 正戊烷的燃烧热大于3531.3 kJ·mol-1
B. 相同质量的烷烃、碳的质量分数越大,燃烧放出的热量越多
C. 正丁烷转化为异丁烷的热化学方程式为:CH3CH2CH2CH3(g) ![]() CH3CH(CH3)CH3(g) △H =+8.4kJ·mol-1
CH3CH(CH3)CH3(g) △H =+8.4kJ·mol-1
D. 甲烷燃烧的热化学方程式为:CH4(g)+2O2(g) ![]() CO2(g) +2H2O(g) △H =-891.0kJ·mol-1
CO2(g) +2H2O(g) △H =-891.0kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.Na2O2遇到湿润的紫色石蕊试纸后,石蕊试纸最终变成蓝色
B.Na2O2晶体中阳离子和阴离子个数比为2:1
C.Na2O2与CO2反应生成0.1 mol O2时转移电子0.4 mol
D.向饱和烧碱溶液中加入2 g Na2O2,充分反应完后,溶液中c(Na+)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型高性能电池的开发与研究已成为当下信息产业化时代的迫切要求、某研究团队设计研制了种高性能的磷酸铁锂(LiFePO4,简称LFP)电池。正极材料为磷酸铁锂,与Al相连,负极材料为石墨,与Cu相连,正、负之间存在电解质并通过聚合物隔膜隔开,此膜只允许Li+通过,其工作原理如图所示,总反应为Li(1-x)C6十LiFePO4![]() LiC6+ Li(1-x) FePO4。下列有关说法正确的是
LiC6+ Li(1-x) FePO4。下列有关说法正确的是
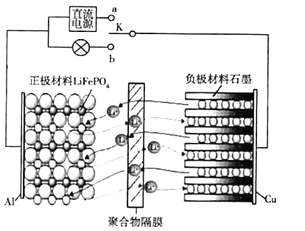
A.当开关K置于a时,Li+由右向左穿过聚合物隔膜到达正极
B.当开关K置于a时,正极材料上的电极反应为: Li(1-x) FePO4 +xLi ++xe- =LiFePO4
C.该电池的正、负极之间可以用Na2SO4水溶液作电解质溶液
D.当开关K置于b时,负极上的电极反应为:LiC6- xe- = Li(1-x) C6+xLi+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素有着多变价态和种类繁多的化合物,在工农业生产中有重要的应用。
(1)同周期元素中,比氮元素的第一电离能大的元素共有______________种。
(2)NF3与汞共热可制得N2F2。
①NF3的几何构型为______________,N2F2 中σ键和π键的个数比为_____________。
②已知汞位于第六周期,与锌同族。基态汞原子的价电子排布式为_____________。
(3)H3N-BH3分子中B原子的杂化轨道类型为_________,该分子的熔沸点比乙烷高,原因是________________________。
(4)由B、N、F元素组成的离子化合物中,B、N、F原子的个数比为1:1: 8,其阴阳离子是等电子体,该化合物中的阴离子是__________(填离子符号)。
(5)氮化硼晶体结构如图所示。
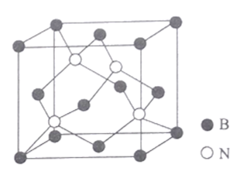
①该晶体中含有的微粒间作用力为______________________。
②图中N原子的坐标参数为 (![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );________。
);________。
③已知BN晶胞中相邻且最近的硼、氢原子的核间距为acm,NA为阿伏加德罗常数的值.其密度为_____________gcm-3 (列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHC2O4溶液的pH < 7。常温下,向pH=8.4的Na2C2O4溶液中滴加0.1mol/L的HCl溶液,溶液pH与pOH[pOH=-lgc(OH-)]的变化关系如图所示,下列各点所示溶液中微粒的物质的量浓度关系一定正确的是

A. a点:c(H+)+c(HC2O4-)+2c(H2C2O4)=c(OH-)
B. b点:c(Cl-)>c(H2C2O4)+c(HC2O4-)+c(C2O42-)
C. c点:c(Na+)=c(HC2O4-)+ c(C2O42-)+c(Cl-)
D. d点:c(OH-)+ c(Cl-)>c(H+)+2c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质相互混合反应后,最终有白色沉淀生成的是( )
①过量Na2O2投入到CuCl2溶液中
②过量Ba(OH)2溶液和硫酸铝溶液混合
③少量Ca(OH)2投入过量NaHCO3中
④澄清石灰水中通入少量CO2
⑤CaCl2与NaOH的混合溶液中通入过量CO2
A.全部B.①⑤C.②③④D.②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】福酚美克是一种影响机体免疫力功能的药物,可通过以下方法合成:
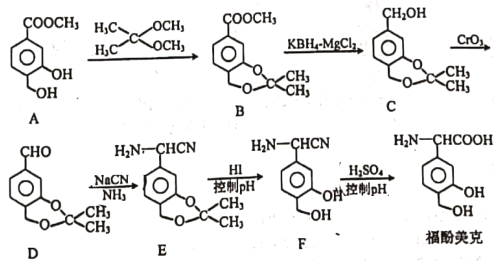
(1)B中的含氧官能团有________和_________(填名称);
(2)C→D的转化属于_________反应(填反应类型).
(3)已知E→F的转化属于取代反应,则反应中另—产物的结构简式为______。
(4) A (C9H10O4)的一种同分异构体X满足下列条件:
I.X分子有中4种不同化学环境的氢。
II. X能与FeCl3溶液发生显色反应。
III. lmol X最多能与4 mol NaOH发生反应
写出该同分异构体的结构简式:_____________。
(5)已知:![]()
![]()
![]() +R3CHO,根据已有知识并结合相关信息.
+R3CHO,根据已有知识并结合相关信息.
写出以  为原料制备
为原料制备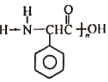 的合成路线流程图(无机试剂任用)。____________
的合成路线流程图(无机试剂任用)。____________
合成路线流程图示例如下:CH3CH2Br![]() CH3CH2OH
CH3CH2OH ![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1
COS(g)+H2(g) K=0.1
反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是
A. 升高温度,H2S浓度增加,表明该反应是吸热反应
B. 通入CO后,正反应速率逐渐增大
C. 反应前H2S物质的量为7mol
D. CO的平衡转化率为80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com