
【题目】在密闭容器中:按CO2与H2的物质的量之比为1:3进行投料,发生反应2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) △H<0,在5MPa 下测得不同温度下平衡体系中各种物质的体积分数 ( V% ) 如图所示,下列说法中正确的是
CH3CH2OH(g)+3H2O(g) △H<0,在5MPa 下测得不同温度下平衡体系中各种物质的体积分数 ( V% ) 如图所示,下列说法中正确的是
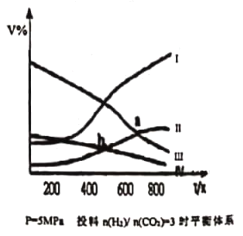
A.表示CH3CH2OH组分的曲线是IV
B.图中曲线交点a、b 对应的上述反应平衡常数Ka > Kb
C.图中曲线交点a 对应的 CO2 转化率为 40%
D.若甲、乙两个密闭容器起始时的容积、温度及投料方式均相同,甲:恒温恒压,乙;恒温恒容,反应达平衡时CH3CH2OH产率:甲<乙
【答案】AC
【解析】
A.该反应为放热反应,升高温度平衡向逆反应方向移动,则升高温度CH3CH2OH含量减小,CO2与H2的含量升高,平衡时H2O的含量是CH3CH2OH含量的三倍,符合条件的曲线为Ⅳ,故A正确;
B.因为平衡常数仅与温度有关,该反应为放热反应,升高温度平衡向逆反应移动,所以温度越低,K越大,所以Ka<Kb,故B错误;
C.图中曲线Ⅱ为CO2,曲线Ⅲ为H2O,曲线交点a为二氧化碳和水平衡时的体积分数相等,根据反应2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g)可知,1molCO2反应消耗0.4mol,平衡时为0.6mol,生成水0.6mol,所以CO2转化率为40%,故C正确;
CH3CH2OH(g)+3H2O(g)可知,1molCO2反应消耗0.4mol,平衡时为0.6mol,生成水0.6mol,所以CO2转化率为40%,故C正确;
D.根据反应2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g),随着反应进行,体积减小,甲为恒温恒压,乙为恒温恒容,则甲相对于乙在减小体积,即增大压强,平衡向正反应方向移动,所以反应达平衡时CH3CH2OH产率:甲>乙,故D错误;
CH3CH2OH(g)+3H2O(g),随着反应进行,体积减小,甲为恒温恒压,乙为恒温恒容,则甲相对于乙在减小体积,即增大压强,平衡向正反应方向移动,所以反应达平衡时CH3CH2OH产率:甲>乙,故D错误;
故选AC。


科目:高中化学 来源: 题型:
【题目】等质量的两种金属粉末A、B分别与同浓度的足量稀盐酸反应,都生成+2价金属氯化物,其反应情况如图所示:
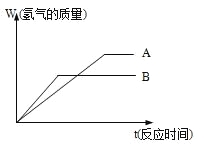
(1) 两种金属的活动性顺序是_____>______
两种金属氯化物的摩尔质量是_____>______
(2) 将两种金属粉末按一定比例混合后,进行甲、乙
丙三组实验,三组实验各取500mL同浓度的盐酸
溶液加入该种混合粉末,产生气体,有关数据如下:
实验序号 | 甲 | 乙 | 丙 |
混合粉末质量(g) | 6.2 | 18.6 | 24.8 |
生成气体气体(mL) | 2240 | 5600 | 5600 |
①乙组实验中,盐酸________(填“过量”、“适量”或“不足量”)
②上述所用的盐酸的物质的量浓度为_____mol/L,混合粉末的平均摩尔质量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物甲是乙(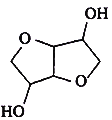 )的同分异构体(不考虑立体异构),1.460g甲与足量饱和碳酸氢钠溶液反应,放出448 mL CO2(标准状况下),下列说法错误的是
)的同分异构体(不考虑立体异构),1.460g甲与足量饱和碳酸氢钠溶液反应,放出448 mL CO2(标准状况下),下列说法错误的是
A.甲的分子式为C6H10O4
B.甲与乙可以发生酯化反应
C.乙的一氯代物有3种
D.甲可能的结构共有8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素有着多变价态和种类繁多的化合物,在工农业生产中有重要的应用。
(1)同周期元素中,比氮元素的第一电离能大的元素共有______________种。
(2)NF3与汞共热可制得N2F2。
①NF3的几何构型为______________,N2F2 中σ键和π键的个数比为_____________。
②已知汞位于第六周期,与锌同族。基态汞原子的价电子排布式为_____________。
(3)H3N-BH3分子中B原子的杂化轨道类型为_________,该分子的熔沸点比乙烷高,原因是________________________。
(4)由B、N、F元素组成的离子化合物中,B、N、F原子的个数比为1:1: 8,其阴阳离子是等电子体,该化合物中的阴离子是__________(填离子符号)。
(5)氮化硼晶体结构如图所示。
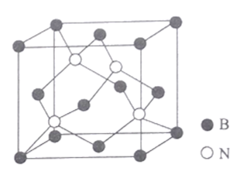
①该晶体中含有的微粒间作用力为______________________。
②图中N原子的坐标参数为 (![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );________。
);________。
③已知BN晶胞中相邻且最近的硼、氢原子的核间距为acm,NA为阿伏加德罗常数的值.其密度为_____________gcm-3 (列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是( )
A. 将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水
B. 将pH=11的氨水稀释1000倍,测得pH>8,说明NH3·H2O为弱碱
C. 加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3受热不稳定
D. 将红热的Pt丝伸入右图所示的锥形瓶中,瓶口出现少量红棕色气体,说明氨气的氧化产物为NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质相互混合反应后,最终有白色沉淀生成的是( )
①过量Na2O2投入到CuCl2溶液中
②过量Ba(OH)2溶液和硫酸铝溶液混合
③少量Ca(OH)2投入过量NaHCO3中
④澄清石灰水中通入少量CO2
⑤CaCl2与NaOH的混合溶液中通入过量CO2
A.全部B.①⑤C.②③④D.②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 A 是单质,A、B、C、D、E 五种物质均含同一种元素,X 是地壳中含量最多的元素形成的单质,相互转化关系如图所示.回答下列问题:

(1)通常情况下,若A为气体,C、D都是大气污染物;
①写出下列反应的化学方程式
B![]() C_________________
C_________________
E![]() C_________________
C_________________
②实验室中检验B的操作方法是_________________。
③标准状况下,将盛满D的试管倒扣在盛满水的水槽中,一段时间后,假定溶质不扩散,则试管中所得溶液的物质的量浓度为____________。
(2)通常情况下,若A为淡黄色固体:
①写出B与C反应的化学方程式:_______________________。
②将C通入溴水中的现象是______,发生反应的离子方程式是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 达到化学平衡时4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系:2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300 ℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)![]() 2 C(g)+2D(g) ΔH=Q, 2 min末达到平衡,生成0.8 mol D。
2 C(g)+2D(g) ΔH=Q, 2 min末达到平衡,生成0.8 mol D。
(1)300℃时,该反应的平衡常数表达式为K=______________,已知K300℃<K350℃,则ΔH____0(填“>”或“<”)。
(2)在2 min末时,B的平衡浓度为________,D的平均反应速率为________。
(3)若温度不变,缩小容器容积,则A的转化率________(填“增大”“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com