
【题目】0.1 mol的镁、铝混合物溶于100 mL 2mol·L-1H2SO4溶液中,然后再滴加1 mol·L-1NaOH溶液。请回答:
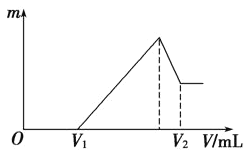
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示。当V1=120mL时,则金属粉末中n(Mg)=________,V2=________mL。
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=________mL。
(3)若向300mL 1 mol/LAL2(SO4)3的溶液中逐渐加入浓度为1mol/L的![]() 溶液,若产生2.34克白色沉淀,则加入的NaOH溶液的体积可能为__________毫升。
溶液,若产生2.34克白色沉淀,则加入的NaOH溶液的体积可能为__________毫升。
(4)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol·L-1硫酸溶解此混合物后,再加入460 mL 1 mol·L-1NaOH溶液,所得沉淀中无Al(OH)3。满足条件的a的取值范围是________。
【答案】0.02 mol 480 400 90mL或2370 mL 0.4≤a <1
【解析】
(1)根据图象可知,在滴加NaOH溶液到体积V1=120mL过程中,没有沉淀生成,说明硫酸有剩余,滴加的NaOH用于中和剩余硫酸,V1=120mL时,剩余的H2SO4与滴加的NaOH恰好完全反应,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,设MgSO4为xmol,Al2(SO4)3为ymol,根据守恒列方程求算n(Mg);当滴加NaOH溶液到体积V2时,Al(OH)3完全溶解,沉淀是Mg(OH)2,溶液是Na2SO4和NaAlO2混合液.根据守恒有:![]() ,据此求出n(NaOH),再利用V=n/c计算;
,据此求出n(NaOH),再利用V=n/c计算;
(2)当溶液中Mg2+、Al3+恰好沉淀完全时,即沉淀达到最大值,此时,溶液是Na2SO4溶液,根据SO42-离子和Na+离子守恒有![]() 求出n(NaOH),再利用V=n/c计算;
求出n(NaOH),再利用V=n/c计算;
(3)发生反应![]() ,
,![]() ,NaOH溶液可能少量只发生反应1,也可能量较多,反生反应1和反应2,根据沉淀质量计算;
,NaOH溶液可能少量只发生反应1,也可能量较多,反生反应1和反应2,根据沉淀质量计算;
(4)反应后的混合溶液,再加入460mL 1mol·L-1的NaOH溶液,所得沉淀中无Al(OH)3,溶质为硫酸钠、偏铝酸钠,由于为金属混合物,则a<1,根据钠离子守恒,应满足n(NaOH)≥2n(Na2SO4)+n(NaAlO2),根据铝元素守恒用x表示出n(NaAlO2),据此确定a的取值范围。
(1)100mL2mol/L的H2SO4溶液中硫酸的物质的量为:0.1L×2mol/L=0.2mol,
当V1=120mL时,此时,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,
由Na+离子守恒可知,n(Na2SO4)=0.5n(Na+)=0.5n(NaOH)=0.5×0.12L×1mol·L-1=0.06mol,
设MgSO4为xmol,Al2(SO4)3为ymol,则:
根据Mg原子、Al原子守恒有:x+2y=0.1
根据SO42-离子守恒有:x+3y=0.2-0.06=0.14,
联立解得:x=0.02;y=0.04,
所以金属粉末中n(Mg)=0.02mol,n(Al)=2y=2×0.04mol=0.08mol;
滴加NaOH溶液到体积V2时,溶液是Na2SO4和NaAlO2混合液,根据SO42-离子、Na+离子和Al原子守恒有:![]() ,所以
,所以![]() ,
,
故答案为:0.02;480;
(2)当溶液中Mg2+、Al3+恰好沉淀完全时,此时溶液是Na2SO4溶液,根据SO42-离子和Na+离子守恒有:![]() ,,所以
,,所以![]() ,
,
故答案为:400;
(3) 发生反应![]() ,
,![]() ,当NaOH量少时只发生反应1,
,当NaOH量少时只发生反应1, ![]() ,则NaOH体积
,则NaOH体积![]() 。当NaOH量多时,发生反应1和2,反应1中NaOH消耗物质的量为
。当NaOH量多时,发生反应1和2,反应1中NaOH消耗物质的量为![]() ,反应2中参加反应Al(OH)3物质的量为0.6mol-0.03mol=0.57mol,消耗NaOH物质的量
,反应2中参加反应Al(OH)3物质的量为0.6mol-0.03mol=0.57mol,消耗NaOH物质的量![]() ,故总消耗NaOH体积
,故总消耗NaOH体积![]() ,
,
故答案为:90mL或2370 mL;
(4)由于为金属混合物,则a<1,Al的物质的量为0.1(1-a)mol,反应后的混合溶液,再加入460mL1mol·L-1的NaOH溶液,所得沉淀中无Al(OH)3,溶质为硫酸钠、偏铝酸钠,根据铝元素守恒可知n(NaAlO2)=0.1(1-a)mol,根据钠离子守恒,应满足n(NaOH) ≥2n(Na2SO4)+n(NaAlO2),即0.46×1≥2×0.1×2+0.1(1-a),解得a≥0.4,故0.4≤a <1,
故答案为:0.4≤a <1。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】某些难溶性铅盐可用作涂料,如秦俑彩绘中使用的铅白(PbCO3)和黄金雨中黄色的PbI2。室温下,PbCO3 和 PbI2 在不同的溶液中分别达到溶解平衡时-lgc(Pb2+)与-lgc(CO32-)或-lgc(I-)的关系如图所示。下列说法错误的是
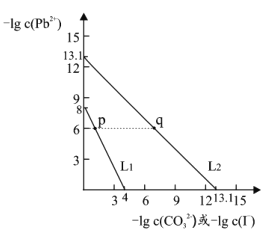
A.Ksp(PbCO3)的数量级为 10-14
B.相同条件下,水的电离程度 p 点大于 q 点
C.L1 对应的是-lgc(Pb2+)与-lgc(I-)的关系变化
D.p 点溶液中加入 Na2CO3 浓溶液,可得白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过测定反应过程中所放出的热量可计算中和热。50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在图示的装置中进行中和反应.回答下列问题:
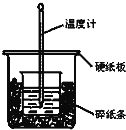
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是___________.
(2)大烧杯上如果不盖硬纸板,求得的中和热数值__________(填“偏大”,“偏小”或“无影响”).
(3)实验中改用60mL 0.50mol/L盐酸跟50mL 0.55mol/LNaOH溶液进行反应,与上述实验相比,所求中和热________(填“相等”“不相等”),简述理由:______________________.
(4)若两溶液的密度都是1g/mL,中和后所得溶液的比热容c=4.18J/(g·℃),三次平行操作测得终止温度与起始温度差(t2﹣t1)分别为:①3.2℃ ②2.2℃ ③3.0℃,写出表示盐酸与NaOH溶液反应的中和热的热化学方程式________________________.(小数点后保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物甲是乙(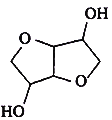 )的同分异构体(不考虑立体异构),1.460g甲与足量饱和碳酸氢钠溶液反应,放出448 mL CO2(标准状况下),下列说法错误的是
)的同分异构体(不考虑立体异构),1.460g甲与足量饱和碳酸氢钠溶液反应,放出448 mL CO2(标准状况下),下列说法错误的是
A.甲的分子式为C6H10O4
B.甲与乙可以发生酯化反应
C.乙的一氯代物有3种
D.甲可能的结构共有8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题
(1)镁燃烧不能用CO2灭火,用化学方程式表示其理由________________________________。
(2)铝制品不能盛放碱性食品原因用离子方程式表示________________________________。
(3)不能用带磨口玻璃塞的试剂瓶盛装碱液的原因用离子方程式表________________________________。
(4)有一种石棉矿叫做青石棉,其化学式为Na2Fe5Si8H2O24,写成氧化物形式的化学式为____________。
(5)已知CuCL是白色难溶的物质,写出CuCL2溶液与SO2反应的离子方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素有着多变价态和种类繁多的化合物,在工农业生产中有重要的应用。
(1)同周期元素中,比氮元素的第一电离能大的元素共有______________种。
(2)NF3与汞共热可制得N2F2。
①NF3的几何构型为______________,N2F2 中σ键和π键的个数比为_____________。
②已知汞位于第六周期,与锌同族。基态汞原子的价电子排布式为_____________。
(3)H3N-BH3分子中B原子的杂化轨道类型为_________,该分子的熔沸点比乙烷高,原因是________________________。
(4)由B、N、F元素组成的离子化合物中,B、N、F原子的个数比为1:1: 8,其阴阳离子是等电子体,该化合物中的阴离子是__________(填离子符号)。
(5)氮化硼晶体结构如图所示。
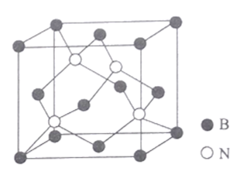
①该晶体中含有的微粒间作用力为______________________。
②图中N原子的坐标参数为 (![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );________。
);________。
③已知BN晶胞中相邻且最近的硼、氢原子的核间距为acm,NA为阿伏加德罗常数的值.其密度为_____________gcm-3 (列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是( )
A. 将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水
B. 将pH=11的氨水稀释1000倍,测得pH>8,说明NH3·H2O为弱碱
C. 加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3受热不稳定
D. 将红热的Pt丝伸入右图所示的锥形瓶中,瓶口出现少量红棕色气体,说明氨气的氧化产物为NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 A 是单质,A、B、C、D、E 五种物质均含同一种元素,X 是地壳中含量最多的元素形成的单质,相互转化关系如图所示.回答下列问题:

(1)通常情况下,若A为气体,C、D都是大气污染物;
①写出下列反应的化学方程式
B![]() C_________________
C_________________
E![]() C_________________
C_________________
②实验室中检验B的操作方法是_________________。
③标准状况下,将盛满D的试管倒扣在盛满水的水槽中,一段时间后,假定溶质不扩散,则试管中所得溶液的物质的量浓度为____________。
(2)通常情况下,若A为淡黄色固体:
①写出B与C反应的化学方程式:_______________________。
②将C通入溴水中的现象是______,发生反应的离子方程式是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pC类似于pH,是指极稀溶液中溶质浓度的负对数。常温下向H2CO3溶液中逐滴滴加NaOH溶液,测得溶液的pC与pH关系如图所示。下列说法错误的是( )
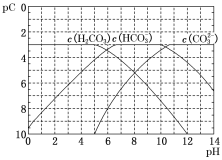
A.在同一溶液中,H2CO3、HCO3–、CO32–不能大量共存
B.H2CO3二级电离平衡常数Ka2的数量级等于10–11
C.当pH=7时,溶液中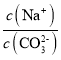 >3
>3
D.向H2CO3溶液滴加NaOH溶液至溶液呈中性的过程中,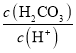 逐渐变小
逐渐变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com