
【题目】根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题。
(1)氧化剂______,还原剂________
(2)氧化产物______,还原产物_______
(3)氧化剂与还原剂的物质的量之比:_________________________
(4)用单线桥的方法表示该反应的电子转移情况。________________________
(5)用双线桥的方法表示该反应的电子转移情况。_________________________
(6)当有8mol NH3参加反应时,转移的电子数目为__________
【答案】Cl2 NH3 N2 NH4Cl 3:2 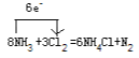
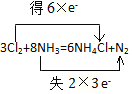 6mol
6mol
【解析】
该反应NH3中N元素化合价由-3价变为0价,化合价升高,所以氨气是还原剂,N2是氧化产物,氯气中氯元素化合价由0价变为-1价,化合价降低,所以Cl2是氧化剂,NH4Cl是还原产物。
(1)根据分析氧化剂为Cl2,还原剂为NH3;
(2)氧化产物为N2,还原产物为NH4Cl;
(3)氧化剂为Cl2,氨气作还原剂,但只有两个氮元素化合价升高,所以氧化剂和还原剂的物质的量之比为3:2;
(4) N元素化合价由-3价变为0价,化合价升高,每个氮原子失去3个电子,但只有两个氮原子化合价升高,即失去6个电子,氯元素化合价由0价变为-1价,化合价降低,得到电子,用单线桥表示为: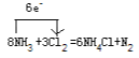 ;
;
(5) N元素化合价由-3价变为0价,化合价升高,每个氮原子失去3个电子,但只有两个氮原子化合价升高,氯元素化合价由0价变为-1价,化合价降低,得到电子,用双线桥表示为: ;
;
(6)当有8mol NH3参加反应时,化合价变化的NH3只有2mol,N元素化合价由-3价变为0价,所以转移的电子数目为6mol。


科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A. 常温常压下,56g丙烯与环丁烷的混合气体中含有4NA个碳原子
B. 7.8g 苯中含有的碳碳双键数目为0.3NA
C. 常温常压下,1.8g重氢甲基(—CD3)中含有的电子数为NA
D. 10g质量分数为46%的乙醇水溶液含有的氢原子总数为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 常温、常压下,4.6 g NO2和N2O4混合气体中含有的氧原子数目为0.2NA
B. 1 mol的羟基与1 mol的氢氧根离子所含电子数均为10NA
C. 将0.1 mol FeCl3溶于1 L水中,所得溶液含Fe3+离子数目为0.1NA
D. 在高温下,1 mol Fe与足量的水蒸气反应,转移电子的数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,回答下列问题:
主族周期 | I A | II A | III A | IV A | V A | VI A | VII A | 0族 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ |
(1)元素①的名称是______;元素②在周期表中所处位置________。
(2)元素②的简单氢化物的结构式为________;
(3)用电子式表示元素⑤与⑦的化合物的形成过程:__________________。
(4)表示④与⑨按原子个数比1:1形成的化合物的电子式:______,该化合物中含有的化学键的类型______。
(6)④、⑥、⑦、⑨四种元素形成的简单离子,离子半径由大到小的顺序是_____(请用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置(I)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电、充电的化学方程式为:2K2S2+KI3![]() K2S4+3KI。装置(II)为电解池的示意图。当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法正确的是( )
K2S4+3KI。装置(II)为电解池的示意图。当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法正确的是( )
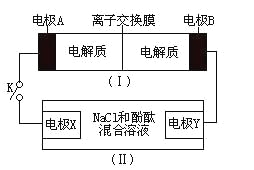
A.K+从右到左通过离子交换膜
B.电极A上发生的反应为:3I--2e-=I3-
C.电极X上发生的反应为:2Cl--2e-=C12↑
D.当有0.1molK+通过离子交换膜,X电极上产生1.12L气体(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室在配制Cu(NO3)2的溶液时,常将Cu(NO3)2固体先溶于较浓的硝酸中,再用蒸馏水稀释到所需的浓度,其目的是_________
(2)FeCl3净水的原理是(用离子方程式表示)_________将AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是______(写化学式)
(3)已知草酸是二元弱酸,常温下测得0.1mol/L的KHC2O4的pH为4.8,则此KHC2O4溶液中c(C2O42-)____c(H2C2O4) (填“大于”或“小于”或“等于”)
(4)泡沫灭火器内装有NaHCO3饱和溶液,该溶液呈现碱性的原因是(用离子方程式表示)______ ;灭火器内另一容器中装有Al2(SO4)3溶液,该溶液呈酸性的原因是(用离子方程式表示)_______,当意外失火时,使泡沫灭火器倒过来摇动即可使药液混合,喷出大量的白色泡沫,阻止火势蔓延,其相关的离子方程式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图的氮循环是生态系统物质循环的重要部分,人类活动加剧了氮循环中的物质转化。
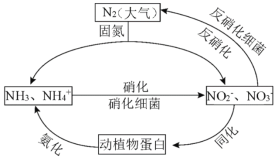
①下列说法正确的是_______(填字母序号)
A.固氮过程中,N2只做氧化剂
B.硝化过程需要有氧化剂参与
C.反硝化过程有助于弥补人工固氮对氮循环造成的影响
D.同化、氨化过程中,实现了氮元素在无机物和有机物之间的转化
②反硝化过程中,CH3OH可作为反应的还原剂,1mol还原剂失去6mol电子。请将该反应的离子方程式补充完整:5CH3OH+□NO3—![]() □_______+□_______+□_______+□_______,_____________
□_______+□_______+□_______+□_______,_____________
(2)研究表明,氮氧化物(NOx)和二氧化硫都与大气中雾霾的形成有关。
①已知:SO2生成SO3总反应方程式是2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-196.6kJ/mol
2SO3(g)ΔH=-196.6kJ/mol
此反应可通过如下两步完成:2NO(g)+O2(g)![]() 2NO2(g)ΔH1=-113kJ/mol
2NO2(g)ΔH1=-113kJ/mol
NO2(g)+SO2(g)![]() SO3(g)+NO(g)ΔH2=_______。
SO3(g)+NO(g)ΔH2=_______。
②一定温度下,向2L恒容密闭容器中充入NO2和SO2各1mol,5min达到平衡,此时容器中NO2和NO的浓度之比为1∶3,则NO2的平衡转化率是_______。
(3)砷(As)是第四周期ⅤA族元素,其化合物,有着广泛的用途。
①AsH3的稳定性比NH3的稳定性_______(填“强’’或“弱’’)。用原子结构解释原因_______。
②常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式_______。
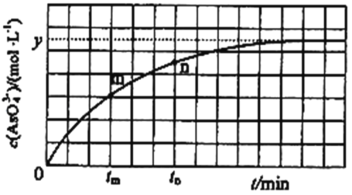
③298K时,将20mL3xmolL-1Na3AsO3、20mL3xmolL-1I2和20mLNaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-![]() AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43﹣)与反应时间(t)的关系如图所示。若平衡时溶液的pH=14,则该反应的平衡常数K为_______。
AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43﹣)与反应时间(t)的关系如图所示。若平衡时溶液的pH=14,则该反应的平衡常数K为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-氯丙烷和2-氯丙烷分别与NaOH乙醇溶液共热的反应,下列有关说法不正确的是( )
A. 产物相同B. 碳氢键断裂的位置相同
C. 反应类型相同D. 1-氯丙烷和2-氯丙烷都能与NaOH水溶液共热的发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A分子式为C2H4,可发生以下系列转化,已知B、D是生活中常见的两种有机物,下列说法不正确的是( )
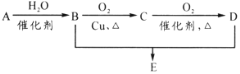
A.75%(体积比)的B溶液常用于医疗消毒
B.D、E都能与NaOH溶液反应
C.由B、D制备E常用浓硫酸作脱水剂
D.B、D、E三种物质可以用饱和Na2CO3溶液鉴别
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com