
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
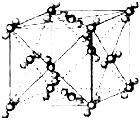 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中B、D、F原子最外电子层的P能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如图所示.E的电负性在该周期中最大.镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaF为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中B、D、F原子最外电子层的P能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如图所示.E的电负性在该周期中最大.镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaF为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
 (10分)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F。其中B、D、F原子最外电子层的P能级(轨道)上的电子处于半满状态。通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右下图所示。E的电负性在该周期中最大。镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaF为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料。
(10分)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F。其中B、D、F原子最外电子层的P能级(轨道)上的电子处于半满状态。通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右下图所示。E的电负性在该周期中最大。镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaF为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料。
试回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
(1)基态Ga原子的核外电子排布式为 。
(2)A、B、C的第一电离能由大到小的顺序为 。
(3)B元素的单质分子中有 个π键。
(4)上述A的氧化物分子中心原子采取______杂化,其晶胞中微粒间的作用力为 。
(5)FH3沸点与比BH3 (填“高”或“低”),原因是 。
(6)固体CrE3?6H2O溶于水可能有几种不同组成的配离子,实验将含0.2665gCrE3?6H2O的溶液通过H-离子交换树脂(只交换配阳离子),交换出的酸用0.125mol/L的氢氧化钠溶液8.00mL中和。已知配离子配位数为6,则该配离子是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com