
【题目】按要求书写离子方程式:
(1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性_____________________________
(2)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42﹣恰好完全沉淀_________________
(3)重铬酸铵[(NH4)2Cr2O7]受热发生氧化还原反应,下列各组重铬酸铵受热分解产物的判断符合实际的是__________
A.CrO3+NH3+H2O B.Cr2O3+NH3+H2O
C.CrO3+N2+H2O D.Cr2O3+N2+H2O
(4)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,KMnO4被还原成Mn2+,消耗KMnO4物质的量为__________。
【答案】 Ba2++2OH﹣+SO42﹣+2H+=BaSO4↓+2H2O Ba2++OH﹣+SO42﹣+H+=BaSO4↓+H2O D 0.032
【解析】(1)向NaHSO4溶液中滴入Ba(OH)2溶液,当氢氧根离子恰好被完全中和时溶液为中性,所以离子方程式为Ba2++SO42-+2OH-+2H+=BaSO4↓+2H2O,故答案为:Ba2++SO42-+2OH-+2H+=BaSO4↓+2H2O;
②向Ba(OH)2溶液中逐滴加入NaHSO4溶液至Ba2+恰好完全沉淀,反应生成硫酸钡、氢氧化钠和水,离子方程式为:H++SO42-+OH-+Ba2+=BaSO4↓+H2O;故答案为:H++SO42-+OH-+Ba2+=BaSO4↓+H2O;
(3)重铬酸铵[(NH4)2Cr2O7]是一种受热易分解的盐,分解时发生氧化还原反应,N元素的化合价应升高,Cr元素的化合价应降低,即N元素由-3价可能升高为0价,Cr元素的化合价由+6价降低为+3价,只有D符合,故选D;
(4)n(KI)=0.06mol,与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则n(I2)=n(KIO3)=0.02mol,共失去电子的物质的量为2×0.02mol+0.02mol×[5-(-1)]=0.16mol,则消耗KMnO4的物质的量的是![]() =0.032mol,故答案为:0.032。
=0.032mol,故答案为:0.032。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】甲醇是一种绿色能源,是机动车燃油的最佳替代品。请回答下列有关问题:
(1)用CO可以合成甲醇。已知:
ⅰ.CH3OH(g)+ ![]() O2(g)=CO2(g)+2H2O(l) △H=-764.5 kJmol-1;
O2(g)=CO2(g)+2H2O(l) △H=-764.5 kJmol-1;
ⅱ.CO(g)+ ![]() O2(g)=CO2(g) △H=-283.0 kJmol-1;
O2(g)=CO2(g) △H=-283.0 kJmol-1;
ⅲ.H2(g)+ ![]() O2(g)=H2O(g) △H=-285.8 kJmol-1;
O2(g)=H2O(g) △H=-285.8 kJmol-1;
则 CO(g)+2H2(g)![]() CH3OH(g) △H=________kJ·mol-1。
CH3OH(g) △H=________kJ·mol-1。
(2)利用CO2及H2为原料,在合适的催化剂(如Cu/ZnO催化剂)作用下,也可合成CH3OH,涉及的反应有:
ⅳ.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-53.7 kJmol-1平衡常数 K1;
CH3OH(g)+H2O(g) △H=-53.7 kJmol-1平衡常数 K1;
ⅴ.CO2(g)+H2(g)![]() CO(g)+H2O(g)△H=+41.2 kJmol-1平衡常数K2。
CO(g)+H2O(g)△H=+41.2 kJmol-1平衡常数K2。
下列四组实验,若控制CO2和H2初始投料比均为1∶2.2,经过相同反应时间测得如下实验数据:
温度(K) | 催化剂 | CO2转化率(%) |
543 | Cu/ZnO纳米棒材料 | 12.3 |
543 | Cu/ZnO纳米片材料 | 10.9 |
553 | Cu/ZnO纳米棒材料 | 15.3 |
553 | Cu/ZnO纳米片材料 | 12.0 |
①CO(g)+2H2(g)![]() CH3OH(g)的平衡常数K=___________(用含K1、K2的表达式表示)。
CH3OH(g)的平衡常数K=___________(用含K1、K2的表达式表示)。
②有利于提高CO2转化为CH3OH平衡转化率的措施有_________。
a.使用Cu/ZnO纳米棒衬料
b.使用Cu/ZnO纳米片材料
c.降低反应温度
d.保持投料比不变,增加反应物的浓度
e.增大CO2和H2的初始投料比
③由表格中的数据可知,相同温度下不同的催化剂对CO2的转化率不同,造成该结果的原因是_________________________________________。
(3)甲醇燃料电池是目前技术最成熟,应用最广泛的一种燃料电池,其工作原理如下图所示:

①a气体的名称是_________。
②甲池所在电极为原电池的______极,其电极反应式为__________________________。
③电解液中,H+的移动方向为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①溴乙烷的沸点38.4 ℃;
②NaBr+H2SO4(浓)![]() NaHSO4+HBr↑;
NaHSO4+HBr↑;
③2HBr+H2SO4(浓)![]() Br2+SO2↑+2H2O。
Br2+SO2↑+2H2O。
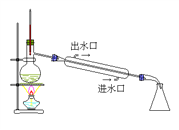
实验室制备溴乙烷(C2H5Br)的装置如下图,步骤如下:
①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;
②在圆底烧瓶中加入10 mL 95%乙醇、28 mL 78%浓硫酸,然后加入研细的13 g溴化钠和几粒碎瓷片;
③小心加热,使其充分反应。 回答下列问题:
(1)实验室用乙醇、浓硫酸、溴化钠制取溴乙烷的总反应的化学方程式为:____________________。
(2)反应时若温度过高,可看到有红棕色气体产生,该气体化学式为:________。
(3)为了更好地控制温度,除用图示的小火加热外,更好的加热方式为________________。
(4)①反应结束后,U形管内粗制的C2H5Br呈棕黄色。为了除去粗产品中的杂质,可以选择下列试剂中的________(填字母),所需的主要玻璃仪器为________________。
A.NaOH溶液 B.Na2SO3溶液 C.CCl4
②要进一步制得纯净的C2H5Br,可用水洗,然后______________(填操作名称,下同),再加入无水CaCl2,最后进行__________________。
(5)下列几项实验步骤,可用于检验溴乙烷中溴元素,其正确的操作顺序是:取少量溴乙烷,然后_____(填序号)。
①加热 ②加入AgNO3溶液 ③加入稀HNO3酸化 ④加入NaOH溶液 ⑤冷却。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的分离说法正确的是
A. 检查是否漏水是滴定管、容量瓶、分液漏斗等仪器使用的第一步操作
B. 碘水中加CCl4振荡静置后,上层为紫色,下层几乎为无色
C. 可用加热法分离NH4Cl(s)和I2(s)
D. 蒸馏、分馏和干馏都是利用组分沸点不同而分离的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1mol两种气体烃组成的混合气完全燃烧后得3.36L(标况)CO2和3.6g水,对于组成判断正确的是
A. 可能是甲烷和乙烷的混合气体 B. 一定是甲烷和乙烯的混合气体
C. 混合气体中一定没有甲烷 D. 混合气体中一定没有乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了将混有Na2SO4、NaHCO3的NaCl固体提纯,制得纯净的氯化钠溶液,某学生设计了如下图所示的实验方案:

已知碳酸氢钠在加热条件下能分解成碳酸钠、二氧化碳和水,而NaCl和Na2SO4固体加热时不发生化学变化。请回答下列问题:
(1)操作①盛放药品可选用___________(填仪器名称)。
(2)操作②为什么不用Ba(NO3)2溶液,其理由是:___________________________。
(3)进行操作②后,判断SO42-已除尽的方法是:______________________________。
(4)操作③的目的是:____________________________________________________。
(5)此设计方案是否严密___________(填“是”或“否”)理由_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】看下列仪器装置图,回答下列问题:
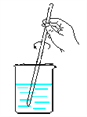
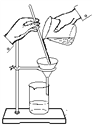
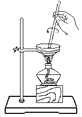

A B C D E
(1)粗盐的提纯需要上面的哪些装置?_________________(填字母符号)
(2)分离以下混合物应该选择使用什么装置?(填字母符号)
①酒精和水:_____________
②二氧化锰和蔗糖:______________
③花生油和水:___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com