
【题目】用某浓度NaOH溶液滴定一元酸HA的滴定曲线如图所示(横坐标为滴入NaOH的体积,纵坐标为所得混合液的pH;甲基橙变色范围为3.1~4.4)。下列判断正确的是
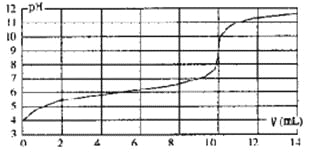
A.HA的浓度为l×10-4mol·L-1
B.实验时可选甲基橙作指示剂
C.V=10mL,酸碱恰好中和
D.pH=7时,溶液中c(Na+)>c(A-)
 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】某电路板生产企业的水质情况及国家允许排放的污水标准如下表所示。为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如下图所示。查阅资料:
平衡Ⅰ:![]()
平衡Ⅱ:![]()
项目 | 废水水质 | 排放标准 |
pH | 1.0 | 6~9 |
Cu2+/mgL-1 | 72 | ≤0.5 |
NH4+/mgL-1 | 2632 | ≤15 |
下列说法错误的是( )
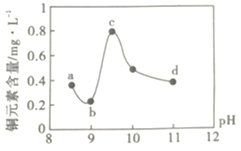
A.a~b段发生的反应为:![]()
B.b~c段:随pH升高,Cu(OH)2的量增加,导致平衡Ⅰ正向移动,铜元素含量上升
C.c~d段:随pH升高,c(OH-)增加,平衡Ⅰ逆向移动,铜元素含量下降
D.d点以后,随c(OH-)增加,铜元素含量可能上升
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容积均为1L的甲、乙两个恒容容器中,分别充入2molA、2molB和1molA、1molB,相同条件下,发生下列反应:A(g)+B(g)![]() xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示,下列说法不正确的是
xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示,下列说法不正确的是
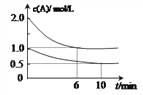
A. x=1
B. 此条件下,该反应的平衡常数K=4
C. 给乙容器升温可缩短反应达平衡的时间但不能提高平衡转化率
D. 甲和乙中B的平衡转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国芝加哥大学化学研究所近日揭示了WO3/CeO2-TiO2双催化剂在低温下催化氮的污染性气体转化为无毒气体,其过程如图所示
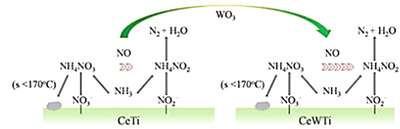
(1)Ti价电子排布式为______________,其能量最高的能层是___________。
(2)N、O、H三种原子的电负性由大到小的顺序为___________________。
(3)NO2-的空间构型为___________,与NO3-互为等电子体的分子为_______________
(4)WO3可作为苯乙烯氧化的催化剂![]() +H2O2
+H2O2![]()
![]() +H2O
+H2O
①![]() 中碳原子的杂化方式为_________。
中碳原子的杂化方式为_________。
②1molH2O2中δ键个数为____________。
③![]() 属于______________晶体。
属于______________晶体。
(5)W和Ti可形成金属互化物,某W和Ti的金属互化物如图所示,则该晶体的化学式为__________。
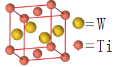
(6)金属钛的晶体堆积方式为 ____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的化学用语不正确的是
A. 闪锌矿(ZnS)经CuSO4溶液作用后,转化为铜蓝(CuS):ZnS + Cu2+ === CuS + Zn2+
B. 0.1 mol/L 的醋酸溶液pH约为3:CH3COOH ![]() CH3COO- + H+
CH3COO- + H+
C. 电解NaCl溶液,阴极区溶液pH增大:2H2O + 2e- === H2↑+ 2OH-
D. 钢铁发生吸氧腐蚀,负极反应为:Fe-3e- === Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器内,800℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)800℃,反应达到平衡时,NO的物质的量浓度为__________ mol/L;升高温度,NO的浓度增大,则该反应是________(填“放热”或“吸热”)反应。
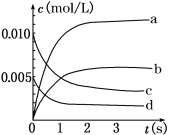
(2)如下图中表示NO2变化的曲线是________(填字母序号a、b、c、d)。用O2表示从0~2 s内该反应的平均速率v=________ mol/(L·s)。
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: RX+Mg![]() RMgX (RX为卤代烃,X为卤族原子),生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
RMgX (RX为卤代烃,X为卤族原子),生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
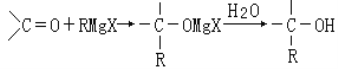
现以2-丁烯和必要的无机物为原料合成F,进而合成一种分子式为C10H16O4的具有六元环的物质J,合成线路如下:(G的核磁共振氢谱有三组峰)
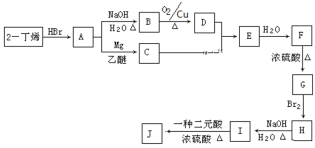
请按要求填空:
(1)F的系统命名:___________________________,E的结构简式是_________________________
(2)C→E的反应类型是______________,F→G的反应类型是___________________
(3)写出I→J化学反应方程式:___________________________________________
(4)A的同分异构体共有______种
(5)M为D的同分异构体且能发生银镜反应,写出所有M的结构简式_______________;其中核磁共振氢谱中出现3组峰的物质与新制氢氧化铜悬浊液在煮沸条件下发生反应的方程式为:______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将0.04mol·L-1的某酸(A)溶液和0.02mol·L-1NaOH溶液等体积混合得混合溶液Q。
(1)若A为CH3COOH,Q呈酸性,溶液中所有离子按浓度由大到小排列的顺序是___;若A为HCl,100℃时(Kw=10-12),溶液中由水电离出的H+浓度为___mol·L-1;若A为H2S,Q接近中性,则HS-的电离能力___水解能力(填“>”“<”“=”或“无法确定”)。
(2)根据(1)中信息比较相同条件下,浓度均为0.01mol·L-1的①NaHS、②CH3COONa、③NaCl溶液中,阴离子总浓度由大到小的顺序为___(填序号)。
(3)用浓度为0.01mol·L-1的NaOH溶液滴定相同体积、相同浓度的①HCl溶液、②CH3COOH溶液、③H2S溶液,当滴定至中性时,消耗NaOH溶液的体积分别为amL、bmL、cmL,则a、b、c的大小关系是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是一种重要的金属,以钛铁矿[主要成分为钛酸亚铁(FeTiO3),还含有少量Fe2O3]为原料制备钛的工艺流程如图所示。
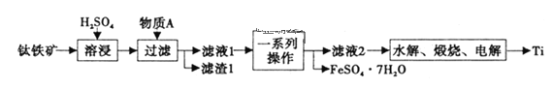
(1)滤液1中钛元素以TiO2+形式存在,则“溶浸”过程发生的主要反应的化学方程式为___。
(2)物质A为___(填化学式),“一系列操作”为___。
(3)“水解”步骤中生成TiO2·xH2O,为提高TiO2·xH2O的产率,可采取的措施有___、___。(写出两条)。
(4)将少量FeSO4·7H2O溶于水,加入一定量的NaHCO3溶液,可制得FeCO3,写出反应的离子方程式___;若反应后的溶液中c(Fe2+)=2×10-6mol·L-1,则溶液中c(CO32-)=___mol·L-1。(已知:KSP(FeCO3)=2.025×10-11)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com