
【题目】对于 0.1 mol/L Na2SO3溶液,正确的是( )
A.升高温度,溶液 pH 降低
B.c(Na+)=2c(SO![]() )+c(HSO
)+c(HSO![]() )+c(H2SO3)
)+c(H2SO3)
C.c(Na+)+c(H+)=2c(SO![]() )+2c(HSO
)+2c(HSO![]() )+c(OH-)
)+c(OH-)
D.加入少量 NaOH 固体,c(SO![]() )与c(Na+)均增大
)与c(Na+)均增大
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(实验内容及记录)
实验编号 | 实验温度 | 试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | |||
① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(1)请完成此实验设计,其中:V1=_________,V2=___________。
(2)根据上表中实验①、②的数据,可以得到的结论是_________________________________。
(3)探究温度对化学反应速率的影响,应选择__________(填实验编号)。
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。

该小组同学根据图2所示信息提出了新的假设,并设计以下实验方案继续进行实验探究。
实验编号 | 实验温度/℃ | 试管中所加试剂及其用量 | 再向试管中加入某种固体 | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | ||||
④ | 25 | 2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t |
该小组同学提出的假设是___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10 mol2·L-2,下列说法不正确的是( )
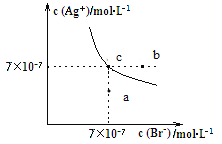
A.在t ℃时,AgBr的Ksp为4.9×10-13 mol2·L-2
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t ℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)的平衡常数K≈816
AgBr(s)+Cl-(aq)的平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯氧化铁是现代电子工业的重要材料.以下是用硫酸厂产生的烧渣![]() 主要成分为
主要成分为![]() 、
、![]() 、FeO、
、FeO、![]() 为原料制备高纯氧化铁
为原料制备高纯氧化铁![]() 软磁
软磁![]() 的生产流程示意图,下列说法不正确的是
的生产流程示意图,下列说法不正确的是![]()
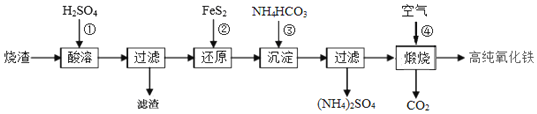
A.酸浸时,常需将烧渣粉碎、并加入过量![]() ,其目的是提铁元素的浸出率,同时抑制铁离子的水解
,其目的是提铁元素的浸出率,同时抑制铁离子的水解
B.加入![]() 时,发生反应
时,发生反应![]() 的离子方程式为
的离子方程式为![]()
C.加入![]() 为了生成
为了生成![]() ,检验
,检验![]() 是否洗涤干净的方法是取最后一次洗涤液少量放入试管,滴加盐酸酸化的氯化钡溶液,若无沉淀生成,说明洗涤干净
是否洗涤干净的方法是取最后一次洗涤液少量放入试管,滴加盐酸酸化的氯化钡溶液,若无沉淀生成,说明洗涤干净
D.煅烧时空气中的氧气作氧化剂,所以用氯气代替空气也可得到高纯氧化铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化学工业基础原料和清洁液体燃料。已知制备甲醇的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度/℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=______(用K1、K2表示)。
(2)反应③的ΔH____0(填“>”或“<”)。
(3)500℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度相等,且均为0.1mol·L-1,则此时υ正____υ逆(填“>”、“=”或“<”)
(4)某温度下在2L恒容密闭容器中加入CH3OH发生反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g),测得有关数据如下:
CH3OCH3(g)+H2O(g),测得有关数据如下:
反应时间/min | 0 | 1 | 2 | 3 | 4 |
n(CH3OH)/mol | 1.02 | 0.42 | 0.22 | 0.02 | 0.02 |
①反应在2min内以CH3OCH3表示的化学反应速率为____,
②该温度下的反应的平衡常数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2 mol·L-1的一元酸HA与等浓度NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )

A. HA为强酸
B. 该混合溶液pH=7.0
C. 该混合溶液中:c(A-)+c(Y)=c(Na+)
D. 图中X表示HA,Y表示OH-,Z表示H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl △H=+QkJ/mol(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行上述反应,下列叙述正确的是( )
Si(s)+4HCl △H=+QkJ/mol(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行上述反应,下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ
C.反应至4min时,若HCl浓度为0.12mol/L,则H2的反应速率为0.03mol/(L·min)
D.反应吸收0.025QkJ热量时,生成的HCl通入100mL1mol/L的NaOH溶液中恰好完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K时,Ksp(NiS)=1.0×10-21,Ksp(FeS)=6.0× 10-18,其沉淀溶解平衡曲线如图所示(图中R表示Ni或Fe),下列说法正确的是(已知: ![]() ≈2.4,
≈2.4, ![]() ≈3.2) ( )
≈3.2) ( )

A. M点对应的溶液中,c(S2-)≈3.2×10-11 mol·L-1
B. 与P点相对应的NiS的分散系是均一稳定的
C. 向Q点对应的溶液中加水,可转化成N点对应的溶液
D. FeS+Ni2+![]() NiS+Fe2+的平衡常数K=6000
NiS+Fe2+的平衡常数K=6000
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知pOH=-lgc(OH-)。T℃时,往50mL0.1mol·L-1MOH溶液中滴加0.1mol·L-1盐酸,溶液pH、pOH随滴入盐酸体积的变化如下图所示,以下说法正确的是
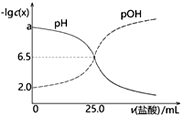
A. 盐酸与MOH溶液恰好中和时溶液pH=6.5
B. a=12
C. 盐酸滴定MOH实验中选择酚酞做指示剂比选甲基橙误差更小
D. T℃时,MOH的电离平衡常数Kb约为1.0×10-3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com