
【题目】将下列装置如图连接,D、F、X、Y、E 都是铂电极,C是铁电极。甲,乙,丙三个装置中电解前后溶液的体积都是500mL。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。下列说法不正确的是( )

A.电源B 极的名称是负极,丁中Y极附近颜色变深
B.乙装置中电解一段时间后,加入0.2mol盐酸则可以恢复原来的浓度
C.设甲池中溶液的体积在电解前后都是500ml,当乙池所产生气体的体积为4.48L(标准状况)时,甲池中所生成物质的物质的量浓度为0.2mol/L
D.甲装置中电解反应的总化学方程式是: CuSO4+Fe![]() Cu+ FeSO4
Cu+ FeSO4
【答案】B
【解析】
试题分析:A、根据题意知电源接通后,向乙中滴入酚酞试液,在F极附近显红色,说明F极氢离子放电,溶液呈碱性,F极为电解池的阴极,B为电源的负极,氢氧化铁胶体胶粒带正电,向阴极移动,则丁中Y极附近颜色变深,正确;B、乙装置中电解总反应为2Cl- + 2H2O ![]() H2↑ + Cl2↑ + 2OH-,电解一段时间后,通入氯化氢气体才可以食盐水恢复原来的浓度,错误;C、根据反应2Cl- + 2H2O
H2↑ + Cl2↑ + 2OH-,电解一段时间后,通入氯化氢气体才可以食盐水恢复原来的浓度,错误;C、根据反应2Cl- + 2H2O ![]() H2↑ + Cl2↑ + 2OH-当乙池所产生气体的体积为4.48L(标准状况)时,转移电子的物质的量为0.2mol,由电子守恒结合反应CuSO4+Fe
H2↑ + Cl2↑ + 2OH-当乙池所产生气体的体积为4.48L(标准状况)时,转移电子的物质的量为0.2mol,由电子守恒结合反应CuSO4+Fe![]() Cu+ FeSO4知生成硫酸亚铁的物质的量为0.1mol,物质的物质的量浓度为0.2mol/L,正确;D、甲装置中C为铁电极,作电解池的阳极,电解反应的总化学方程式是: CuSO4+Fe
Cu+ FeSO4知生成硫酸亚铁的物质的量为0.1mol,物质的物质的量浓度为0.2mol/L,正确;D、甲装置中C为铁电极,作电解池的阳极,电解反应的总化学方程式是: CuSO4+Fe![]() Cu+ FeSO4,正确。
Cu+ FeSO4,正确。


科目:高中化学 来源: 题型:
【题目】CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并进行相关探究。
已知:

该小组用下图所示装置进行实验(夹持仪器略)。

请回答下列问题:
(1)仪器X的名称是__________。
(2)实验操作的先后顺序是① →_____→ → → ⑤。
①检查装置的气密性后加入药品 ②熄灭酒精灯,冷却
③在“气体入口”处通干燥HCl ④点燃酒精灯,加热
⑤停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是_________。
(4)装置D中发生反应的离子方程式是___________________________________。
(5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:
①若杂质是CuCl2,则产生的原因是____________________________________________。
②若杂质是CuO,则产生的原因是________________________________________________。
(6)若m克CuCl2·2H2O全部转化为CuO(铜元素无损耗),则固体质量减少_____________克(用含m的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2014新课标1】〔化学—选修5:有机化学基础〕(15分)
席夫碱类化合物G在催化、药物、新材料等方面有广泛应用。合成G的一种路线如下:
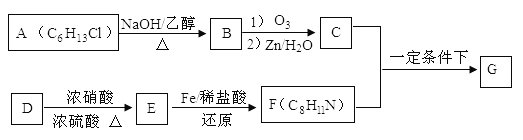
已知以下信息:
①
②一摩尔B经上述反应可生居二摩尔C,且C不能发生银镜反应。
③D属于单取代芳烃,其相对分子质量为106。
④核磁共振氢谱显示F苯环上有两种化学环境的
⑤
回答下列问题:
(1)由A生成B的化学方程式为 ,反应类型为
(2)D的化学名称是 ,由D生成E的化学方程式为:
(3)G的结构简式为
(4)F的同分异构体中含有苯环的还有____种(不考虑立体异构)。其中核磁共振氢谱中有4组峰,且面积比为6:2:2:1的是_______。(写出其中的一种的结构简式)。
(5)由苯和化合物C经如下步骤可合成N-异丙基苯胺。

反应条件1所选择的试剂为____________;反应条件2所选择的试剂为________;I的结构简式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25 ℃、101 kPa下,1 g C8H18(l)燃烧生成CO2和液态H2O时放出48.40 kJ的热量,表示上述反应的热化学方程式正确的是
A. C8H18(l)+![]() O2(g)===8CO2(g)+9H2O(g) ΔH=-48.40 kJmol-1
O2(g)===8CO2(g)+9H2O(g) ΔH=-48.40 kJmol-1
B. C8H18(l)+![]() O2(g)===8CO2(g)+9H2O(l) ΔH=-5 517.6 kJmol-1
O2(g)===8CO2(g)+9H2O(l) ΔH=-5 517.6 kJmol-1
C. C8H18(l)+![]() O2(g)===8CO2(g)+9H2O(g) ΔH=+5 517.6 kJmol-1
O2(g)===8CO2(g)+9H2O(g) ΔH=+5 517.6 kJmol-1
D. 2C8H18(l)+25O2(g)===16CO2(g)+18 H2O(l) ΔH=-5 517.6 kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016年天津卷】反-2-己烯醛(D)是一种重要的合成香料,下列合成路线是制备D的方法之一。根据该合成路线回答下列问题:
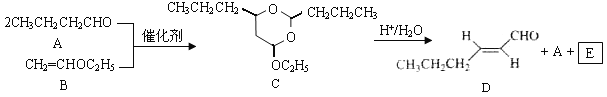
已知: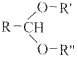
![]() RCHO+R'OH+R"OH
RCHO+R'OH+R"OH
(1)A的名称是__________;B分子中共面原子数目最多为__________;C分子中与环相连的三个基团中,不同化学环境的氢原子共有__________种。
(2)D中含氧官能团的名称是__________,写出检验该官能团的化学反应方程式:__________。
(3)E为有机物,能发生的反应有__________。
a.聚合反应b.加成反应c.消去反应d.取代反应
(4)B的同分异构体F与B有完全相同的官能团,写出F所有可能的结构:________。
(5)以D为主要原料制备己醛(目标化合物),在方框中将合成路线的后半部分补充完整。
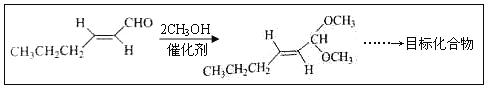
(6)问题(5)的合成路线中第一步反应的目的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
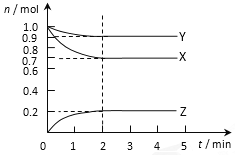
(1) 该反应的化学方程式为:_________________。
(2) 反应开始至2min,用Z表示的平均反应速率为:_________________。
(3) 在下列事实中,什么因素影响了化学反应的速率?
①同浓度、同体积的盐酸中放入大小相同的铁片和镁片产生气体有快有慢:__________;
②熔化的KClO3放出气泡很慢,加入少量MnO2很快产生气体:_____________。
(4) 在密闭容器里,通入a mol X(g)和b mol Y(g),发生反应X(g) + Y(g)![]() 2Z(g),当改变下列条件时,反应速率会发生什么变化?(选填“增大”、“减小”或“不变”)
2Z(g),当改变下列条件时,反应速率会发生什么变化?(选填“增大”、“减小”或“不变”)
①升高温度,反应速率____________;
②保持容器体积不变,充入不参加反应的惰性气体,反应速率____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJmol-1。若向三份等体积、等物质的量浓度的NaOH溶液中分别加入醋酸、浓硫酸、稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Q1kJ、Q2kJ、Q3kJ。则三者的由小到大关系是________(用Q1、Q2、Q3表示)。
(2)如图所示A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其目的是_____________________; 若实验中不加盖泡沫塑料板,则求得的中和热数值______(填偏大、偏小、无影响)

(3)实验室用50mL 0.50molL-1盐酸、50mL 0.55molL-1 NaOH溶液利用上图装置,进行测定中和热的实验。假设盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容c=4.18 J/(g℃)。为了计算中和热,实验时还需测量的数据有(填序号)________。
A.反应前盐酸的温度 B.反应前盐酸的质量
C.反应前氢氧化钠溶液的温度 D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.4 |
2 | 20.2 | 20.4 | 23.6 |
3 | 20.5 | 20.6 | 23.8 |
依据该学生的实验数据计算,该实验测得的中和热ΔH为________。(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应的产物并不改变的是( )
A. Na和O2 B. NaOH和CO2 C. Na2O2和CO2 D. 木炭(C)和O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com