
【题目】(14分)己知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。
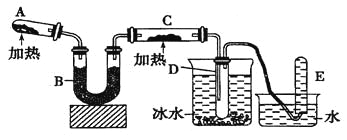
回答下列问题:
(1)A中生成氨气反应的化学方程式是 _________________;
(2)B中加入的干燥剂是_______(填序号)①浓硫酸②无水氯化钙③碱石灰;
(3)能证明氨与氧化铜反应的现象:①C中______、②D中有无色液体生成;
设计实验检验D中无色液含有水:取少量液体于试管中,加入少量_______粉末,现象为______。
(4)写出氨气与氧化铜反应的化学方程式 _______________。若收集到2.24L(STP)氮气,计算转移电子数为______________。
【答案】(1)2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O (2)③
CaCl2+2NH3↑+2H2O (2)③
(3)黑色粉末变红;无水硫酸铜;白色变为蓝色 (4)2NH3+3CuO![]() 3Cu+N2+3H2O;0.6NA
3Cu+N2+3H2O;0.6NA
【解析】
试题(1)装置图分析判断,制备氨气是实验室制备氨气的实验装置氯化铵和氢氧化钙混合加热反应生成氨气,反应的化学方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(2)B是干燥氨气的装置,浓硫酸、氯化钙都和氨气反应,所以需要选择碱石灰干燥,故答案为:③;
(3)氨气与氧化铜反应的方程式为2NH3+3CuO![]() 3Cu+N2+3H2O,反应过程中C装置中固体由黑色变红色,证明氨与氧化铜反应,D中有无色液体生成说明生成水;由于水与硫酸铜变为胆矾而显蓝色,所以检验水的方法是取少量液体于试管中,加入少量无水硫酸铜,现象为白色变为蓝色;
3Cu+N2+3H2O,反应过程中C装置中固体由黑色变红色,证明氨与氧化铜反应,D中有无色液体生成说明生成水;由于水与硫酸铜变为胆矾而显蓝色,所以检验水的方法是取少量液体于试管中,加入少量无水硫酸铜,现象为白色变为蓝色;
(3)根据以上分析可知氨气与氧化铜反应的方程式为2NH3+3CuO![]() 3Cu+N2+3H2。2.24L标准状况下的氮气是0.1mol,根据方程式可知反应中生成1mol氮气转移电子6mole-,所以生成0.1mol氮气,转移电子为0.6mol,即0.6NA。
3Cu+N2+3H2。2.24L标准状况下的氮气是0.1mol,根据方程式可知反应中生成1mol氮气转移电子6mole-,所以生成0.1mol氮气,转移电子为0.6mol,即0.6NA。


科目:高中化学 来源: 题型:
【题目】有机玻璃的单体甲基丙烯酸甲酯(MMA) 的合成原理如下:
 (MMA)
(MMA)
下列说法正确的是
A. 若反应①的原子利用率为100%,则物质X为CO2
B. 可用分液漏斗分离MMA和甲醇
C. ![]() 、
、![]() 均可发生加成反应、氧化反应、取代反应
均可发生加成反应、氧化反应、取代反应
D. MMA与H2反应生成Y,能与NaHCO3溶液反应的Y的同分异构体有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用光洁铂丝蘸取某无色溶液在无色火焰上灼烧,直接观察到火焰呈黄色。下列判断正确的是
A. 只含有Na+ B. 一定含有Na+,可能含K+
C. 既含有Na+,又含K+ D. 可能含有Na+,可能含有K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的用途与其性质的对应关系错误的是 ( )
A. 氯气用于自来水消毒— 次氯酸的强氧化性
B. 碘化银用于人工降雨— 使空气中水蒸汽凝聚
C. 氢氟酸腐蚀玻璃— 强酸性
D. 溴化银用于照相术— 光照分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水体污染的治理是化学工作者研究的重要课题。
(1)水体常见污染物之一的氨氮主要指游离氨或铵盐,可以通入一定量的氯气,利用产生的HC1O除去。
已知:NH4++HClO=NH2Cl+H++H2O △H=akJ/mol
2NH2Cl+HClO=N2+H2O+3H++3Cl- △H=bkJ/mol
NH4++4HClO=NO3-+6H++4Cl-+H2O △H=ckJ/mol
则2NH4++3HClO=N2+3H2O+5H++3Cl- △H=______kJ/mol
(2)电解法也可除去水中的氨氮,实验室用石墨电极电解一定浓度的(NH4)2SO4与NaCl的酸性混合溶液来模拟。
①电解时,阳极的电极反应式为______________。电解过程中溶液初始Cl-浓度和pH对氨氮去除速率与能耗(处理一定量氨氮消耗的电能)的影响关系如图1和图2所示:
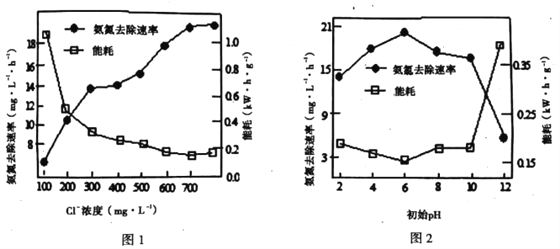
②图l中当Cl-浓度较低时、图2中当初始pH达到12时,氨氮去除速率低而能耗高的原因可能是_______________________。
③图2中,pH为____时处理效果最佳;当pH过低时,处理效果不佳的原因可能是_______。
(3)废水中的重金属离子通常用沉淀法除去。已知Ksp(NiS) =1.1×l0-21.Ksp(CuS)=1.3×10-36,国家规定的排放标准:镍低于1.1×10-5mol/L,铜低于7.8×l0-5mol/L。则需要控制溶液中S2-的浓度不低于______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和开发CO、CO2的应用对构建人类的生态文明建设有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH 1=+489.0 kJ·mol-1
C(s) + CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1。则CO还原Fe2O3(s)的热化学方程式为__________。
(2)电子工业中使用的一氧化碳常以甲醇为原料CH3OH=CO + 2H2,该反应是经历脱氢、分解两步反应实现的。
ⅰ(脱氢):2CH3OH ![]() HCOOCH3 + 2H2
HCOOCH3 + 2H2
ⅱ(分解): ……
①ⅰ(脱氢)反应的机理可以用下图表示:图中中间产物X的结构简式为________。
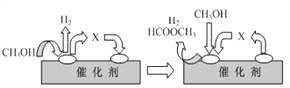
②写出ⅱ(分解)反应的化学方程式____________。
(3)科学家们积极探讨控制温室气体CO2的排放,减缓全球变暖措施和方法。
①Li4SiO4可用于富集得到高浓度CO2。原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生。请写出700℃时反应的化学方程式为:____________。
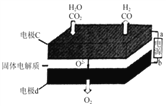
②固体氧化物电解池(SOEC)用于高温电解CO2/H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如图。写出电极c上发生的电极反应式:_________、_________。
(4)催化剂可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图。
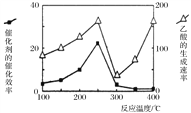
在250-300℃过程中影响速率的主要因素是___________;在300-400℃过程中影响速率的主要因素是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是
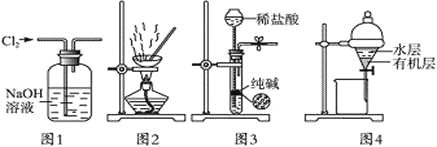
A. 用图1所示装置除去Cl2中含有的少量HCl
B. 用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C. 用图3所示装置制取少量纯净的CO2气体
D. 用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.2000mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作如下: ①用标准溶液润洗滴定管2-3 次,取标准NaOH 溶液注入碱式滴定管至“0”刻度线以上;②固定好滴定管并使滴定管尖嘴充满液体;③调节液面至“0”或“0”刻度线稍下,并记下读数;④量取20.00mL待测液注入清净的锥形瓶中,并加入3滴酚酞溶液;⑤用标准液滴定至终点,记下滴定管液面读数;⑥重复以上滴定操作2-3 次。
请回答下列问题:
(1)步骤④中,若在取盐酸的滴定管尖嘴部分有气泡且取液结束前气泡消失,则测定结果____(填“偏大”、“偏小”或“无景响”)。
(2)判断到达滴定路点的依据是____________。
(3)以下是实验数据记录表
滴定次数 | 盐酸体积(mL) | NaOH溶液体积读数(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.00 | 21.10 |
2 | 20.00 | 0.00 | 19.40 |
3 | 20.00 | 0.00 | 19.32 |
以上表可以看出,第1次滴定记录的NaOH溶液体积明显多于后两次的体积,其可能的原因是__________
A.NaOH 标准液保存时间过长,有部分变质
B.锥形瓶用待测液润洗
C.配制NaOH 标准液所用的药品中混有KOH固体
D.滴定结束时,俯视读数
(4)根据上表记录数据,通过计算可得,该盐酸浓度为_____mol/L。
(5)室温下,用0.100mol/LNaOH溶液分别滴定20.00mL0.100mol/L的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是_________
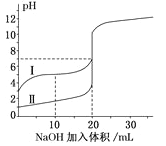
A.V(NaOH)=20mL时,c(Cl-)=c(CH3COO-)
B.I表示的是滴定盐酸的曲线
c.pH=7时,滴定醋酸消耗V(NaOH)小于20mL
D.V(NaOH)=10mL时,醋酸溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小明很喜欢化学实验课,今天要学习“探究铁及其化合物的氧化性或还原性”。
(1)实验前小明预测Fe2+既有还原性又有氧化性。你认为他预测的依据是_______________。
(2)小明欲用实验证明他的预测。实验室提供了下列试剂:3%的过氧化氢溶液、锌粒、铜片、0.1 mol·L-1氯化亚铁溶液、硫氰化钾溶液、新制氯水。
①若小明计划在0.1 mol·L-1氯化亚铁溶液滴入新制氯水,探究Fe2+的还原性,你预计可能发生的反应的离子方程式是________________________,可能观察到的现象是溶液由浅绿色变为________色。
②实验中,小明发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。你认为可选_________滴入小明所得的混合液中,并通过溶液出现______色的现象,证明小明的观点和实验方案都是正确的。
③对于证明Fe2+具有氧化性,小明认为金属单质都具有还原性,并分别将铜片、锌粒投入氯化亚铁溶液中,结果铜片没变化,锌粒逐渐变小。由此说明三种金属的还原性由强至弱的顺序为___________________(填化学式)。
④实际上Fe2+的还原性较强,实验室的氯化亚铁溶液常因氧化而变质,除去杂质的方法是_________________________________________,相关反应的离子方程式是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com