
【题目】研究和开发CO、CO2的应用对构建人类的生态文明建设有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH 1=+489.0 kJ·mol-1
C(s) + CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1。则CO还原Fe2O3(s)的热化学方程式为__________。
(2)电子工业中使用的一氧化碳常以甲醇为原料CH3OH=CO + 2H2,该反应是经历脱氢、分解两步反应实现的。
ⅰ(脱氢):2CH3OH ![]() HCOOCH3 + 2H2
HCOOCH3 + 2H2
ⅱ(分解): ……
①ⅰ(脱氢)反应的机理可以用下图表示:图中中间产物X的结构简式为________。
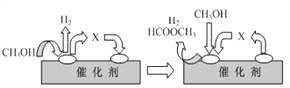
②写出ⅱ(分解)反应的化学方程式____________。
(3)科学家们积极探讨控制温室气体CO2的排放,减缓全球变暖措施和方法。
①Li4SiO4可用于富集得到高浓度CO2。原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生。请写出700℃时反应的化学方程式为:____________。
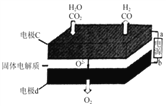
②固体氧化物电解池(SOEC)用于高温电解CO2/H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如图。写出电极c上发生的电极反应式:_________、_________。
(4)催化剂可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图。
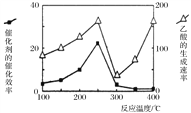
在250-300℃过程中影响速率的主要因素是___________;在300-400℃过程中影响速率的主要因素是___________。
【答案】 Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H =-28.5 kJ·mol-1 HCHO HCOOCH3 ![]() CH3OH + CO Li2CO3+Li2SiO3
CH3OH + CO Li2CO3+Li2SiO3![]() CO2↑+Li4SiO4 CO2+2e-===CO+O2- H2O+2e-===H2+O2- 催化剂 温度
CO2↑+Li4SiO4 CO2+2e-===CO+O2- H2O+2e-===H2+O2- 催化剂 温度
【解析】分析:(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJmol-1,
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJmol-1,由盖斯定律①-②×3得到热化学方程式;
(2)①根据分解反应过程和反应机理图示分析判断,中间产物为甲醛;②反应为分解反应,根据分解反应过程来判断;
(3)①根据题干信息,反应物为CO2与Li4SiO4,生成物有Li2CO3,根据质量守恒进行解答;②二氧化碳在a极得到电子发生还原反应生成一氧化碳同时生成氧离子,反应电极反应式为:CO2+2e-═CO+O2-,水中的氢元素化合价降低被还原,电极反应式为:H2O+2e-=H2+O2-;
(4)在250-300℃过程中,催化效率的降低,导致反应速率也降低,催化剂是影响速率的主要因素;而在300-400℃时,催化效率低且变化程度较小,但反应速率增加较明显,故温度是影响速率的主要因素。
详解:(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJmol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJmol-1
由盖斯定律①-②×3得到Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H =-28.5 kJ·mol-1,
因此,本题正确答案是:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H =-28.5 kJ·mol-1;
(2)①根据图示和分解反应过程,结合原子守恒分析,甲醇去氢后得到的是甲醛,因此,本题正确答案是:HCHO;
②第二步为分解反应,甲酸甲酯分解得到甲醇和一氧化碳,化学方程式为:HCOOCH3 ![]() CH3OH + CO,因此,本题正确答案是:HCOOCH3
CH3OH + CO,因此,本题正确答案是:HCOOCH3 ![]() CH3OH + CO;
CH3OH + CO;
(3)①在500℃,CO2与Li4SiO4接触后生成Li2CO3,反应物为CO2与Li4SiO4,生成物有Li2CO3,根据质量守恒可以知道产物还有Li2SiO3,所以700℃时反应的化学方程式为:Li2CO3+Li2SiO3![]() CO2↑+Li4SiO4,因此,本题正确答案是:Li2CO3+Li2SiO3
CO2↑+Li4SiO4,因此,本题正确答案是:Li2CO3+Li2SiO3![]() CO2↑+Li4SiO4;
CO2↑+Li4SiO4;
②二氧化碳在a极得到电子发生还原反应生成一氧化碳同时生成氧离子,反应电极反应式为:CO2+2e-═CO+O2-,水中的氢元素化合价降低被还原,电极反应式为:H2O+2e-=H2+O2-,因此,本题正确答案是:CO2+2e-═CO+O2-;H2O+2e-=H2+O2-;
(4)在250-300℃过程中,催化剂是影响速率的主要因素;而在300-400℃时,催化效率低且变化程度较小,但反应速率增加较明显,因此该过程中温度是影响速率的主要因素,温度越高,反应速率越大.因此,本题正确答案是:催化剂 ; 温度。


科目:高中化学 来源: 题型:
【题目】下列有关胶体的说法错误的是
A. 氢氧化铁固体溶于盐酸可得澄清溶液与胶体性质无关
B. 制备氢氧化铁胶体的化学方程式是FeCl3+3H2O ![]() Fe(OH)3↓+3HCl
Fe(OH)3↓+3HCl
C. 检验胶体能否透过滤纸的简便方法:用两张滤纸叠放,在上面滴几滴氢氧化铁胶体,看下层滤纸上是否出现红褐色
D. 氢氧化铁胶体粒子能吸附水中悬浮颗粒并沉降,从而达到净水目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计下列方法对A盐的水溶液进行鉴定:
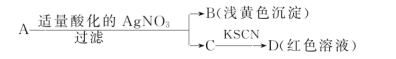
由此得出的结论中,不正确的是
A.D溶液中存在Fe(SCN)3 B.滤液C中有Fe3+
C.B为AgBr D.A一定是FeBr2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 分子里含有双键的有机物一定是烯烃
B. 向蛋白质溶液中加入浓的Na2SO4或CuSO4溶液均可使蛋白质盐析而分离提纯
C. 糖类、油脂、蛋白质均能发生水解反应
D. 相对分子质量为46的烃的含氧衍生物不一定是乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)己知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。
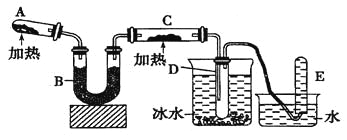
回答下列问题:
(1)A中生成氨气反应的化学方程式是 _________________;
(2)B中加入的干燥剂是_______(填序号)①浓硫酸②无水氯化钙③碱石灰;
(3)能证明氨与氧化铜反应的现象:①C中______、②D中有无色液体生成;
设计实验检验D中无色液含有水:取少量液体于试管中,加入少量_______粉末,现象为______。
(4)写出氨气与氧化铜反应的化学方程式 _______________。若收集到2.24L(STP)氮气,计算转移电子数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验目的能够实现的是( )
A.用托盘天平称取3.23gNaCl固体B.用50mL的量筒量取30.12mL的水
C.向小试管中加入100mL稀盐酸D.用滴管取约1mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿斯巴甜(Aspartame)是一种具有清爽甜味的有机化合物,结构简式如图所示。下列说法不正确的是

A. 阿斯巴甜属于氨基酸,分子式为C14H18N2O5
B. 阿斯巴甜分子的核磁共振氢谱共有11种吸收峰
C. 阿斯巴甜能发生氧化、取代、消去等反应
D. 阿斯巴甜在一定条件下既能与酸反应,又能与碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】印度洋海啸使受灾地区的饮用水受污染,一些地区出现人员腹泻。下列几个步骤能将河水转化为可饮用水,其合理顺序是 ( )
①化学沉降(用明矾) ②消毒杀菌 ③自然沉降 ④加热煮沸
A. ③②①④ B. ③①②④ C. ③①④② D. ①③④②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiFePO4是锂离子电池一种电极材料,其结构稳定、资源丰富、安全性能好、无毒.该电极材料在充放电时的变化如图所示,下列有关说法正确的是( )
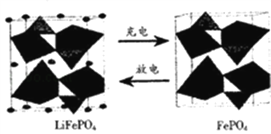
A. 放电时该电极为负极
B. 充电是Li+向阳极移动
C. 充电时该电极发生氧化反应,反应式为LiFePO4﹣e﹣=FePO4+Li+
D. 该电池可以用磷酸溶液作电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com