
【题目】LiFePO4是锂离子电池一种电极材料,其结构稳定、资源丰富、安全性能好、无毒.该电极材料在充放电时的变化如图所示,下列有关说法正确的是( )
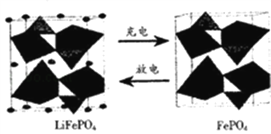
A. 放电时该电极为负极
B. 充电是Li+向阳极移动
C. 充电时该电极发生氧化反应,反应式为LiFePO4﹣e﹣=FePO4+Li+
D. 该电池可以用磷酸溶液作电解质
【答案】C
【解析】分析:在Li、LiFePO4电池放电时,负极上Li失电子发生氧化反应,正极上LiFePO4得电子发生还原反应,根据得失电子确定正负极,根据反应物、生成物书写电极反应式,放电时,阳离子移向正极,金属Li能够与磷酸反应,据此解答。
详解:A、放电时, LiFePO4得电子发生还原反应为正极,充电时发生氧化反应为阳极,故A错误;
B、放电时,阳离子移向正极,充电时Li+向阴极移动,故B错误;
C、放电时, LiFePO4得电子发生还原反应为正极,充电时发生氧化反应为阳极,电极反应式为: LiFePO4﹣e﹣=FePO4+Li+,所以C选项是正确的;
D、金属Li能够与硫酸反应,不可以用磷酸溶液作电解质,故D错误;本题正确答案选C。


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】研究和开发CO、CO2的应用对构建人类的生态文明建设有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH 1=+489.0 kJ·mol-1
C(s) + CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1。则CO还原Fe2O3(s)的热化学方程式为__________。
(2)电子工业中使用的一氧化碳常以甲醇为原料CH3OH=CO + 2H2,该反应是经历脱氢、分解两步反应实现的。
ⅰ(脱氢):2CH3OH ![]() HCOOCH3 + 2H2
HCOOCH3 + 2H2
ⅱ(分解): ……
①ⅰ(脱氢)反应的机理可以用下图表示:图中中间产物X的结构简式为________。
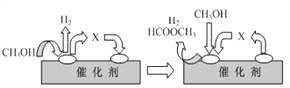
②写出ⅱ(分解)反应的化学方程式____________。
(3)科学家们积极探讨控制温室气体CO2的排放,减缓全球变暖措施和方法。
①Li4SiO4可用于富集得到高浓度CO2。原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生。请写出700℃时反应的化学方程式为:____________。
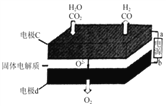
②固体氧化物电解池(SOEC)用于高温电解CO2/H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如图。写出电极c上发生的电极反应式:_________、_________。
(4)催化剂可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图。
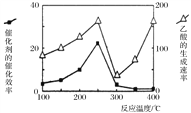
在250-300℃过程中影响速率的主要因素是___________;在300-400℃过程中影响速率的主要因素是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气处理装置中可发生反应:4CO+2NO2 ![]() 4CO2+N2,下列对该反应的说法正确的是
4CO2+N2,下列对该反应的说法正确的是
A. NO2被氧化 B. CO是氧化剂
C. 该条件下,氧化性CO2<NO2 D. 该条件下,还原性CO<N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会等密切相关,下列说法正确的是
A. 绿色化学的核心是应用化学原理对环境污染进行治理
B. 用CO2合成可降解的聚碳酸酯塑料,能减少白色污染及其危害
C. 推广使用煤的液化技术,从根本上减少二氧化碳等温室气体的排放
D. 明矾常用于水体杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小明很喜欢化学实验课,今天要学习“探究铁及其化合物的氧化性或还原性”。
(1)实验前小明预测Fe2+既有还原性又有氧化性。你认为他预测的依据是_______________。
(2)小明欲用实验证明他的预测。实验室提供了下列试剂:3%的过氧化氢溶液、锌粒、铜片、0.1 mol·L-1氯化亚铁溶液、硫氰化钾溶液、新制氯水。
①若小明计划在0.1 mol·L-1氯化亚铁溶液滴入新制氯水,探究Fe2+的还原性,你预计可能发生的反应的离子方程式是________________________,可能观察到的现象是溶液由浅绿色变为________色。
②实验中,小明发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。你认为可选_________滴入小明所得的混合液中,并通过溶液出现______色的现象,证明小明的观点和实验方案都是正确的。
③对于证明Fe2+具有氧化性,小明认为金属单质都具有还原性,并分别将铜片、锌粒投入氯化亚铁溶液中,结果铜片没变化,锌粒逐渐变小。由此说明三种金属的还原性由强至弱的顺序为___________________(填化学式)。
④实际上Fe2+的还原性较强,实验室的氯化亚铁溶液常因氧化而变质,除去杂质的方法是_________________________________________,相关反应的离子方程式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的 SO2气体和 SO3气体相比较,正确的说法是
A. 密度比为 4:5 B. 物质的量之比为 4:5
C. 体积比为 1:1 D. 原子数之比为 3:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下:

(1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入________(填“A”或“B”),再滴加另一反应物。
(2)如下图所示,过滤操作中的一处错误是________________________________________。

(3)判断流程中沉淀是否洗净所用的试剂是__________________________________________。高温焙烧时,用于盛放固体的仪器名称是___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水中的![]() 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中![]() 的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将
的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将![]() 还原为N2,其化学方程式为10Al+6NaNO3+4NaOH===10NaAlO2+3N2↑+2H2O。
还原为N2,其化学方程式为10Al+6NaNO3+4NaOH===10NaAlO2+3N2↑+2H2O。
请回答下列问题:
(1)上述反应中,________元素的化合价升高,则该元素的原子________(填“得到”或“失去”)电子;而________元素的化合价降低,则该元素的原子被________(填“氧化”或“还原”)。
(2)用“双线桥法”表示反应中电子转移的方向和数目:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与胶体性质无关的是( )
A.工业上静电除尘
B.在河流入海处易形成沙洲
C.氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀
D.清晨的阳光穿过茂密的林木枝叶所产生的美丽景象(美丽的光线)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com