
【题目】印度洋海啸使受灾地区的饮用水受污染,一些地区出现人员腹泻。下列几个步骤能将河水转化为可饮用水,其合理顺序是 ( )
①化学沉降(用明矾) ②消毒杀菌 ③自然沉降 ④加热煮沸
A. ③②①④ B. ③①②④ C. ③①④② D. ①③④②
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】已知在100℃的温度下,水的离子积Kw=1×10-12,本题涉及的溶液,其温度均为100℃,下列说法中正确的是
A.0.001mol/L的硫酸溶液,pH=2
B.0.001mol/L的氢氧化钠溶液pH=9
C.0.005mol/L的硫酸溶液与0.01mol/L的氢氧化钠溶液等体积混合,混合溶液的pH为6,溶液显酸性
D.完全中和pH=3的硫酸溶液50mL,需要pH=11的NaOH溶液50mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和开发CO、CO2的应用对构建人类的生态文明建设有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH 1=+489.0 kJ·mol-1
C(s) + CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1。则CO还原Fe2O3(s)的热化学方程式为__________。
(2)电子工业中使用的一氧化碳常以甲醇为原料CH3OH=CO + 2H2,该反应是经历脱氢、分解两步反应实现的。
ⅰ(脱氢):2CH3OH ![]() HCOOCH3 + 2H2
HCOOCH3 + 2H2
ⅱ(分解): ……
①ⅰ(脱氢)反应的机理可以用下图表示:图中中间产物X的结构简式为________。
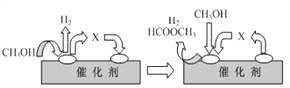
②写出ⅱ(分解)反应的化学方程式____________。
(3)科学家们积极探讨控制温室气体CO2的排放,减缓全球变暖措施和方法。
①Li4SiO4可用于富集得到高浓度CO2。原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生。请写出700℃时反应的化学方程式为:____________。
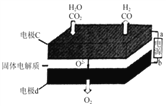
②固体氧化物电解池(SOEC)用于高温电解CO2/H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如图。写出电极c上发生的电极反应式:_________、_________。
(4)催化剂可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图。
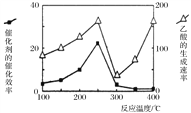
在250-300℃过程中影响速率的主要因素是___________;在300-400℃过程中影响速率的主要因素是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通常条件下,NO2和SO2可以很容易发生反应生成NO和SO3。现将碳跟浓硫酸共热产生的气体X和碳跟浓硝酸共热产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是
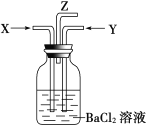
A. 洗气瓶中产生的沉淀是碳酸钡
B. 洗气瓶中产生的沉淀是硫酸钡
C. 在Z导管出来的气体中无二氧化碳
D. 反应一段时间后洗气瓶中溶液的酸性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.2000mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作如下: ①用标准溶液润洗滴定管2-3 次,取标准NaOH 溶液注入碱式滴定管至“0”刻度线以上;②固定好滴定管并使滴定管尖嘴充满液体;③调节液面至“0”或“0”刻度线稍下,并记下读数;④量取20.00mL待测液注入清净的锥形瓶中,并加入3滴酚酞溶液;⑤用标准液滴定至终点,记下滴定管液面读数;⑥重复以上滴定操作2-3 次。
请回答下列问题:
(1)步骤④中,若在取盐酸的滴定管尖嘴部分有气泡且取液结束前气泡消失,则测定结果____(填“偏大”、“偏小”或“无景响”)。
(2)判断到达滴定路点的依据是____________。
(3)以下是实验数据记录表
滴定次数 | 盐酸体积(mL) | NaOH溶液体积读数(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.00 | 21.10 |
2 | 20.00 | 0.00 | 19.40 |
3 | 20.00 | 0.00 | 19.32 |
以上表可以看出,第1次滴定记录的NaOH溶液体积明显多于后两次的体积,其可能的原因是__________
A.NaOH 标准液保存时间过长,有部分变质
B.锥形瓶用待测液润洗
C.配制NaOH 标准液所用的药品中混有KOH固体
D.滴定结束时,俯视读数
(4)根据上表记录数据,通过计算可得,该盐酸浓度为_____mol/L。
(5)室温下,用0.100mol/LNaOH溶液分别滴定20.00mL0.100mol/L的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是_________
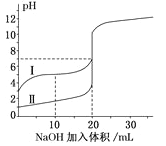
A.V(NaOH)=20mL时,c(Cl-)=c(CH3COO-)
B.I表示的是滴定盐酸的曲线
c.pH=7时,滴定醋酸消耗V(NaOH)小于20mL
D.V(NaOH)=10mL时,醋酸溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl和Cl-两种粒子中,不相同的是···( )
①核内质子数 ②核外电子数 ③最外层电子数 ④核外电子层数
A. ①② B. ②③ C. ③④ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气处理装置中可发生反应:4CO+2NO2 ![]() 4CO2+N2,下列对该反应的说法正确的是
4CO2+N2,下列对该反应的说法正确的是
A. NO2被氧化 B. CO是氧化剂
C. 该条件下,氧化性CO2<NO2 D. 该条件下,还原性CO<N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会等密切相关,下列说法正确的是
A. 绿色化学的核心是应用化学原理对环境污染进行治理
B. 用CO2合成可降解的聚碳酸酯塑料,能减少白色污染及其危害
C. 推广使用煤的液化技术,从根本上减少二氧化碳等温室气体的排放
D. 明矾常用于水体杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水中的![]() 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中![]() 的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将
的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将![]() 还原为N2,其化学方程式为10Al+6NaNO3+4NaOH===10NaAlO2+3N2↑+2H2O。
还原为N2,其化学方程式为10Al+6NaNO3+4NaOH===10NaAlO2+3N2↑+2H2O。
请回答下列问题:
(1)上述反应中,________元素的化合价升高,则该元素的原子________(填“得到”或“失去”)电子;而________元素的化合价降低,则该元素的原子被________(填“氧化”或“还原”)。
(2)用“双线桥法”表示反应中电子转移的方向和数目:_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com