
【题目】I.碳酸钠是一种重要的化工原料,主要采用氨碱法生产。回答下列问题:
(1)已知:①2NaOH(s)+CO2(g)=Na2CO3(s)+H2O(g) ΔH1=127.4kJ/mol
②NaOH(s)+CO2(g) = NaHCO3(s) ΔH2=131.5kJ/mol
反应2NaHCO3(s)=Na2CO3(s) +H2O(g) +CO2(g)的ΔH=____kJ/mol,不同温度下NaHCO3分解反应的平衡常数K313K____K298K(填“大于"“小于”或“等于”),该反应的平衡常数表达式K=______。
(2)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时溶液中![]() =____。(保留一位小数,已知Ksp(BaCO3)=2.6×109 ,Ksp(BaSO4)=1.1×1010)
=____。(保留一位小数,已知Ksp(BaCO3)=2.6×109 ,Ksp(BaSO4)=1.1×1010)
II.Mg﹣H2O2电池可用于驱动无人驾驶的潜航器,该电池以海水为电解质溶液,其工作原理如图所示,电池总反应是:Mg+H2O2+2H+═ Mg2++2H2O

(1)负极材料为_____,发生___反应(填“氧化”或“还原”)
(2)两极电极反应式为:
负极:_________________;正极:_________________;
(3)有4.8gMg反应时时,外电路中转移电子数为______。
【答案】+135.6 大于 c(CO2)·c(H2O) 23.6 Mg 氧化 Mg-2e-=Mg2+ H2O2+2e-+2H+=2H2O 0.4NA或2.408×1023
【解析】
I.(1)①2NaOH(s)+CO2(g)=Na2CO3(s)+H2O(g) △H1=-127.4kJ/mol
②NaOH(s)+CO2(g)═NaHCO3(s) △H2=-131.5kJ/mol
①-2×②整理可得:2NaHCO3(s)=Na2CO3(s)+H2O(g)+CO2(g)的反应热;
根据反应热判断温度对该反应的影响,结合平衡常数的含义,进而可得不同温度下的K值大小;
(2)当碳酸钡、硫酸钡两种沉淀共存时,溶液中钡离子浓度为定值,根据溶度积计算;
II.负极发生氧化反应,正极发生还原反应(或活动性不同的电极,活泼的为负极,不活泼的为正极),正极上溶液中的溶质H2O2获得电子,发生还原反应,Mg是+2价金属,结合闭合回路中电子转移数目相等分析计算。
(1)①2NaOH(s)+CO2(g)=Na2CO3(s)+H2O(g) △H1=-127.4kJ/mol
NaOH(s)+CO2(g)═NaHCO3(s) △H2=-131.5kJ/mol
①-2×②得,2NaHCO3(s)=Na2CO3(s)+H2O(g)+CO2(g) △H =+135.6 kJ/mol;
由于该反应是吸热反应,升高温度,平衡正向移动,化学平衡常数增大,所以K313K>K298K;由于化学平衡常数是可逆反应达到平衡状态时,各种生成物浓度幂之积与各种反应物浓度幂之积的比,固体物质不出现在平衡常数表达式中,生成物只有CO2、H2O是气体,所以根据平衡常数的含义,可得该反应的平衡常数表达式K=c(CO2)·c(H2O);
(2)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中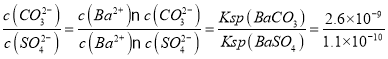 =23.6;
=23.6;
II.(1)在Mg﹣H2O2电池中,Mg失电子发生氧化反应生成Mg2+,所以Mg为负极,失去电子,发生氧化反应;
(2)负极上Mg失去电子,电极反应式为:Mg-2e-=Mg2+;正极上,溶液中H2O2获得电子,发生还原反应,电极反应式为:H2O2 +2e-+2H+=2H2O;
(3) 4.8gMg的物质的量为n(Mg)=4.8g÷24g/mol=0.2mol,由于Mg是+2价的金属,所以在整个闭合回路中电子转移数目为n(e-)=0.2mol×2×NA/mol=0.4NA。


科目:高中化学 来源: 题型:
【题目】相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中均发生反应:![]()
![]() 实验测得有关数据如下表所示:
实验测得有关数据如下表所示:
容器编号 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化/kJ | ||
|
|
| ||
甲 | 2 | 1 | 0 |
|
乙 | 1.8 | 0.9 | 0.2 |
|
丙 | 0 | 0 | 2 |
|
下列判断中正确的是( )
A.![]()
B.若升高温度,反应的热效应不变
C.![]()
D.生成![]() 时放出的热量大于98.5 kJ
时放出的热量大于98.5 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工光合系统装置(如图)可实现以CO2和 H2O 合成CH4。下列有关说法不正确的是()

A. 该装置中铜为正极
B. 电池工作时H+向Cu电极移动
C. GaN 电极表面的电极反应式为: 2H2O-4e-═O2+4H+
D. 反应CO2+2H2O═CH4+2O2中每消耗 1mol CO2转移 4mol e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙烯为原料,在一定条件下可以转化为A、B、C,最后合成有果香的D,转化关系如下图所示。
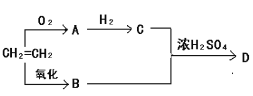
(1)写出物质A中的官能团名称_____;
(2)CH2=CH2与B反应也可以生成D,该反应的反应类型属于_____;
(3)写出B+C→D的方程式___;
(4)下列说法不正确的是____。
A.CH2=CH2能与溴水和酸性高锰酸钾溶液反应,两者的褪色原理不相同
B.物质A与新制Cu(OH)2悬浊液混合后加热,可以出现砖红色沉淀
C.实验室制备物质D时,常用饱和Na2CO3溶液收集产物,且有机层在下层
D.等物质的量的CH2=CH2和C完全燃烧,耗氧量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1 452 kJ·mol-1
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是
A. CH3OH(l)的燃烧热为1 452 kJ·mol-1
B. 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C. ![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)===
Ba(OH)2(aq)===![]() BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D. 3H2(g)+CO2(g)===CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示有关物质的相互转化关系,其中A是由G和某淡黄色固体组成的混合物,I是常见的无色液体,反应①在化工生产中有着重要应用(部分产物和条件已略去)。

(1)写出以下物质的化学式:B_______、F_______。
(2)反应②的离子方程式为_______。
(3)我国首创的由G、空气和海水组成的电池,在航海领域有着极其重要的作用,其工作时正极反应式为_______,该电池最大的优点是只需补充_______〔填“正极”或“负极”〕材料就可接着使用。
(4)向M的水溶液中加入少量A中的淡黄色固体,反应的化学方程式为_______。
(5)25℃时,pH均为5的盐酸和M的水溶液中,由H2O电离出的H+物质的量浓度之比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 1mol—OH含10NA个电子
B. 1molC2H518OH与足量CH3COOH充分反应可得NA个H2O
C. 标准状况下,11.2L丙烯所含的极性共价键数为3NA
D. 常温下,将1mol铁加入到足量的浓硝酸中,生成NO2气体的体积大于67.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电动公交车替代燃油公交车是节能减排、控制雾霾的重要举措之一,下图所示电池是一种正在开发的车载电池。有关该电池的说法正确的是
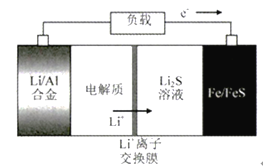
A. 放电时Fe/FeS极是负极
B. 放电时负极反应式为:Al-3e-=Al3+
C. 充电时阳极反应式为:Fe+S2--2e-=FeS
D. 左边电解质可以是LiOH的醇溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为_______________________________________________。
(2)W与Y可形成化合物W2Y,该化合物的电子式为_______________。
II.A、B、C、D均为中学化学常见的纯净物,A是单质。
它们之间有如下的反应关系:
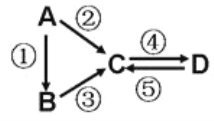
(3)若A是淡黄色单质固体,C、D是氧化物,且C是造成酸雨的主要物质。则C与另一种淡黄色物质反应的化学方程式______________________________________。
(4)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置是________________。
(5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写该反应的离子方程式________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com