
����Ŀ����ͼ��ʾ�й����ʵ��ת����ϵ������A����G��ij����ɫ������ɵĻ���I�dz�������ɫҺ�壬��Ӧ���ڻ���������������ҪӦ�ã����ֲ������������ȥ����

��1��д���������ʵĻ�ѧʽ��B_______��F_______��
��2����Ӧ�ڵ����ӷ���ʽΪ_______��
��3���ҹ��״�����G�������ͺ�ˮ��ɵĵ�أ��ں����������ż�����Ҫ�����ã��乤��ʱ������ӦʽΪ_______���õ�������ŵ���ֻ�貹��_______��������������������ϾͿɽ���ʹ�á�
��4����M��ˮ��Һ�м�������A�еĵ���ɫ���壬��Ӧ�Ļ�ѧ����ʽΪ_______��
��5��25��ʱ��pH��Ϊ5�������M��ˮ��Һ�У���H2O�������H�����ʵ���Ũ��֮��Ϊ_______��
���𰸡�H2 Al2O3 2A1+2OH-+2H2O=2AlO2-+3H2�� O2��2H2O��4e����4OH�� ���� 4AlCl3+6Na2O2+6H2O=4Al��OH��3��+12NaCl+3O2�� 1��104
��������
I�dz�������ɫҺ�壬ӦΪH2O��A����G��ij����ɫ������ɵĻ����û������ˮ��Ӧ�õ�B��D��C����B��D��Ӧ����ˮ��B��D�ֱ�Ϊ�����������е�һ�֣�����֪AΪAl��Na2O2������CΪNaAlO2��EΪAl��OH��3��FΪAl2O3�����F�õ�D��G����GΪAl��DΪO2��BΪH2��G�����ᷴӦ����MΪAlCl3���ݴ˽��
I�dz�������ɫҺ�壬ӦΪH2O��A����G��ij����ɫ������ɵĻ����û������ˮ��Ӧ�õ�B��D�� C����B.��D��Ӧ����ˮ��B��D�ֱ�Ϊ�����������е�һ�֣�����֪AΪAl��Na2O2������CΪNaAlO2��EΪAl(OH)3��FΪAl2O3�����F�õ�D��G����GΪAl��DΪO2��BΪH2��G�����ᷴӦ����MΪAlCl3��
(1)������������֪��BΪH2��FΪAl2O3��
(2)��Ӧ��Ϊ��������������Һ��Ӧ�����ӷ���ʽΪ��2Al+2OH+2H2O�T2AlO2+3H2����
(3)��Al�������ͺ�ˮ��ɵĵ�أ�����������ԭ��Ӧ�������������ŵ��������������ӣ�����ʱ������ӦʽΪ��O2+4e+2H2O�T4OH����Ӧ��Al�����ģ�AlΪ�������õ�������ŵ���ֻ�貹�为�����ϾͿɼ���ʹ�ã��ʴ�Ϊ��O2+4e+2H2O�T4OH��������
(4)��AlCl3��ˮ��Һ�м���������ƣ���Ӧ�Ļ�ѧ����ʽΪ��4AlCl3+6Na2O2+6H2O=4Al��OH��3��+12NaCl+3O2����
(5)25��ʱ��pHΪ5��������Һ�У���H2O�������H+���ʵ���Ũ�ȵ�����Һ������������Ũ��Ϊ109mol/L��pHΪ5��AlCl3��ˮ��Һ��������Ũ��Ϊˮ�����������H2O�������H+���ʵ���Ũ��Ϊ105mol/L���ʶ�����H2O�������H+���ʵ���Ũ��֮��Ϊ109mol/L��105mol/L=1:104���ʴ�Ϊ��1:104��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���һ�ֿ���������ɫ��Դ��CO2��һ���������壬������Ҫ�Ļ���ԭ�ϡ�
��1����֪CO��ȼ���ȡ�HΪ��283kJ��mol-1��CO(g)+2H2(g)![]() CH3OH(l) ��H=��129kJ��mol-1�������CH3OH��ȼ���ȣ�����Ҫ֪��һ����Ӧ���÷�Ӧ���Ȼ�ѧ����ʽΪ___��������д����H�ľ�����ֵ��
CH3OH(l) ��H=��129kJ��mol-1�������CH3OH��ȼ���ȣ�����Ҫ֪��һ����Ӧ���÷�Ӧ���Ȼ�ѧ����ʽΪ___��������д����H�ľ�����ֵ��
��2�����¶Ȳ�ͬ�ݻ���Ϊ1 L��a��b��c��d��e��������ܱ������и�����3molCO2��7molH2�Ļ�����壬�����ʵ�����ʹ��ͬʱ������Ӧ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H=Q kJ��mol-1����Ӧ������ά�ָ������¶Ȳ��䣬���t1ʱ�̸�������H2O���������(H2O)��ͼ��ʾ��
CH3OH(g)+H2O(g) ��H=Q kJ��mol-1����Ӧ������ά�ָ������¶Ȳ��䣬���t1ʱ�̸�������H2O���������(H2O)��ͼ��ʾ��

��Q___(�>����<��)0����������п϶����ڷ�ƽ��״̬����___��
��t2ʱ��ʱ������b������Ӧ����__(����ڡ���С�ڡ����ڡ�)����e������Ӧ���ʣ�
��Td��ʱ���÷�Ӧ��ƽ�ⳣ��K=__��
��3��̼��������Ӧ�üȿɽ���̼�ŷ�Ҳ�ɵõ���Ҫ�Ļ�����Ʒ��
��NaOH��Һ�dz��õ�̼��������ij�β���õ�����Һ��c(HCO3-)��c(CO32-)=2��1����������Һ��pH=___�۳�����Kl(H2CO3)=4.4��10-7��K2(HCO3-)=5��10-11�ݡ�
���������¯ˮ���Ĺ����У���Ҫ��Na2CO3��ˮ���е�CaSO4ת��ΪCaCO3�����ܵ�CaSO4�����Ե�CaCO3��������___��
��4���ü״���Ϊȼ�ϵ�ص�ԭ�ϣ���д���ڼ��Խ����е�ظ�����Ӧʽ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. 25 ��ʱ����ˮ�м�����������NaHSO4��c(H��)����Kw����
B. ��0.1 mol��L-1CH3COOH��Һ�м���������CH3COONa���壬  ��С
��С
C. �����£���BaCO3������Һ�м���Na2CO3���壬c(Ba2+)��С��BaCO3��Ksp��С
D. һ�������£���һ��Ũ�ȵ�CH3COONa��Һ��ˮϡ�ͣ���Һ���������ӵ�Ũ�ȶ���С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ�� X��Y��Z��W ԭ����������������X �ǵؿ��к�������Ԫ����Y ԭ�ӵ������ֻ��һ��������Z λ��Ԫ�����ڱ���A����W ��X����ͬһ���塣����˵����ȷ����
A. ԭ�Ӱ뾶��r(W) > r(Z) > r(Y)
B. ��X��Y ��ɵĻ������о��������ۼ�
C. Y ������������ˮ����ļ��Ա�Z����
D. X �ļ���̬�⻯������ȶ��Ա�W��ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I��̼������һ����Ҫ�Ļ���ԭ�ϣ���Ҫ���ð���������ش��������⣺
(1)��֪����2NaOH(s)+CO2(g)=Na2CO3(s)+H2O(g) ��H1=127.4kJ/mol
��NaOH(s)+CO2(g) = NaHCO3(s) ��H2=131.5kJ/mol
��Ӧ2NaHCO3(s)=Na2CO3(s) +H2O(g) +CO2(g)����H=____kJ/mol����ͬ�¶���NaHCO3�ֽⷴӦ��ƽ�ⳣ��K313K____K298K(��������"��С��������������)���÷�Ӧ��ƽ�ⳣ������ʽK=______��
(2)����BaSO4�������Һ�еμ�Na2CO3��Һ������BaCO3��������ʱ��Һ��![]() =____��������һλС������֪Ksp(BaCO3)=2.6��109 ��Ksp(BaSO4)=1.1��1010��
=____��������һλС������֪Ksp(BaCO3)=2.6��109 ��Ksp(BaSO4)=1.1��1010��
II��Mg��H2O2��ؿ������������˼�ʻ��DZ�������õ���Ժ�ˮΪ�������Һ���乤��ԭ����ͼ��ʾ������ܷ�Ӧ�ǣ�Mg+H2O2+2H+�T Mg2++2H2O

(1)��������Ϊ_____������___��Ӧ������������������ԭ����
(2)�����缫��ӦʽΪ��
������_________________��������_________________��
(3)��4.8gMg��Ӧʱʱ�����·��ת�Ƶ�����Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ֳּ��������绯ѧ�����������ڲⶨ O2��������ͼΪij�����绯ѧ�������� ԭ��ʾ��ͼ����֪�ڲⶨO2�������� �У��������Һ���������ֲ��䡣һ��ʱ ���ڣ���ͨ���������Ĵ�������ΪaL(�� ״��)��ij�缫������b g������˵����ȷ����
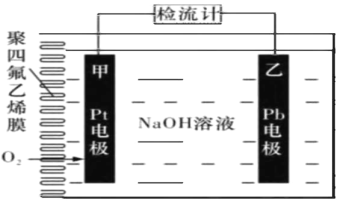
A.Pt�缫Ϊ����
B.��Ӧ������ת��OH-�����ʵ���Ϊ0.125bmol
C.Pb�缫�Ϸ����ĵ缫��ӦΪPb-2e- +2OH- = Pb(OH)2
D.�����������������������Ϊ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϩ��������������������Ĺؼ����������ϩij������X�������Ʊ��������ϣ���ṹ��ͼ��ʾ��3�������ڿռ��ϻ�Ϊ120���нǡ������й�X��˵���������

A. ����ʽΪC22H14O4
B. �ܷ����ӳɡ�ȡ����Ӧ
C. �����ϵ�һ�ȴ�����3��
D. ��������������20��ԭ��λ��ͬһƽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ��2 L�ܱ�������ͨ��һ����������X��Y��������Ӧ��2X(g) + Y(g) ![]() 3Z(g)��Y�����ʵ���n(Y)��ʱ��t�仯��������ͼ��ʾ������˵����ȷ����
3Z(g)��Y�����ʵ���n(Y)��ʱ��t�仯��������ͼ��ʾ������˵����ȷ����
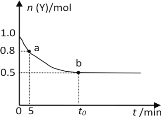
A.t0 minʱ��n(Z)��0.75 mol
B.0~5min�ڣ���X��ʾ�Ļ�ѧ��Ӧ������0.02 mol��L��1��min��1
C.����Ӧ����a���b���
D.b��ʱ�÷�Ӧ�ﵽ������ȣ���Ӧֹͣ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ������к�ˮ��ȡ��ˮ���ִ���ͨ����ˮ��������ʵ�ֺ�ˮ����
B. �ҹ�ɽˮ�����õ�̿�������϶��ĺ���������ʹ�õ�̼��ά��Ϊͬ���칹��
C. ijЩͲװˮʹ�õ���������Ͱ�������Ҷ�����![]() �����Ҷ���������ˮ
�����Ҷ���������ˮ
D. ��һ��һ·������˿��֮·���ô�������21���ͺ���˿��֮·���ļ�ƣ���˿�����Ҫ�ɷ��ǵ����ʣ�������Ȼ�߷��ӻ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com